
【题目】Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和Mn3O4的工艺流程如下:
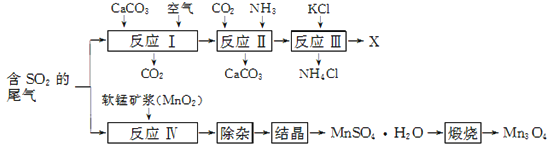
请回答下列问题:
(1) 几种盐的溶解度见下如图。化肥X的化学式为________;为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应________(填操作名称),再洗涤、干燥晶体。
(2) 检验X样品是否含有氯化物杂质的实验操作是________。
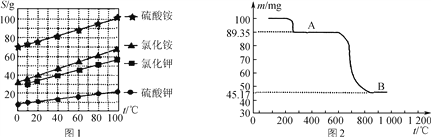
(3) 如图是隔绝空气条件煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:____________________。
(4) 为了测定产品中Mn3O4的纯度,取2.500 g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉碘化钾溶液中,稀释至250 mL,从中取25.00 mL用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点时,消耗20.00 mL标准溶液(2Na2S2O3 +I2===2NaI+Na2S4O6)。
① 样品与浓盐酸发生反应的离子方程式为________。
② 该样品的纯度为________。
【答案】 K2SO4 趁热过滤 取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,再取上层清液滴加硝酸酸化的AgNO3溶液,若无白色沉淀生成,则不含氯化物 3MnSO4![]() Mn3O4+SO2↑+2SO3↑ Mn3O4+8H++2Cl-
Mn3O4+SO2↑+2SO3↑ Mn3O4+8H++2Cl-![]() 3Mn2++Cl2↑+4H2O 91.6%
3Mn2++Cl2↑+4H2O 91.6%
【解析】(1) 根据图中几种盐的溶解度可知,X为溶解度最低的盐,是K2SO4;为获得固体K2SO4,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应 趁热过滤,再洗涤、干燥晶体。
(2) 检验K2SO4样品是否含有氯化物杂质,可取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,再取上层清液滴加硝酸酸化的AgNO3溶液,若无白色沉淀生成,则不含氯化物;
(3) 原MnSO4·H2O的质量为100mg,A点质量为89.35mg,减小的质量为100mg-89.35mg=10.65mg,而100mgMnSO4·H2O中水的质量为100mg×![]() ×100%=10.65mg,可知A为MnSO4,A中Mn元素的质量为89.35mg×
×100%=10.65mg,可知A为MnSO4,A中Mn元素的质量为89.35mg×![]() ×100%=32.54mg,B中氧元素的质量为45.17mg-32.54mg=12.63mg,则B中Mn:O=
×100%=32.54mg,B中氧元素的质量为45.17mg-32.54mg=12.63mg,则B中Mn:O=![]() :
:![]() =3:4,根据元素化合价的判断可知A分解生成B的反应为氧化还原反应,Mn元素化合价升高,则S化合价降低,还原产物为SO2,根据电子守恒或原子守恒可知A→B的化学方程式为3MnSO4
=3:4,根据元素化合价的判断可知A分解生成B的反应为氧化还原反应,Mn元素化合价升高,则S化合价降低,还原产物为SO2,根据电子守恒或原子守恒可知A→B的化学方程式为3MnSO4![]() Mn3O4+SO2↑+2SO3↑;
Mn3O4+SO2↑+2SO3↑;
(4) Mn3O4与浓盐酸混合加热生成氯气和氯化锰,发生反应的离子方程式为Mn3O4+8H++2Cl-![]() 3Mn2++Cl2↑+4H2O;根据:Mn3O4~~~~~Cl2~~~~~I2~~~~2Na2S2O3,Mn3O4的物质的量为0.1000mol·L-1×0.020L×
3Mn2++Cl2↑+4H2O;根据:Mn3O4~~~~~Cl2~~~~~I2~~~~2Na2S2O3,Mn3O4的物质的量为0.1000mol·L-1×0.020L×![]() =0.001mol,该样品Mn3O4的纯度为
=0.001mol,该样品Mn3O4的纯度为![]() ×100%=91.6%。
×100%=91.6%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器内,充入0.2molCO和0.4molH2O,在一定条件下发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
CO2(g)+H2(g) ΔH>0。反应中CO2的浓度(c)随时间(t)的变化关系如图所示。
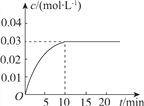
回答下列问题:
(1)下列叙述能判断该反应达到平衡状态的是________(填序号)。
①H2O的质量不再变化
②混合气体的总压强不再变化
③CO、H2O、CO2、H2的浓度都相等
④单位时间内生成amolCO,同时生成amolH2
(2)0~10min时段,反应速率v(H2)=________;反应达到平衡时,c(H2O)=________,CO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠的叙述中,正确的是( )
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验反应得到的混合气体中含有SO2、H2、H2O
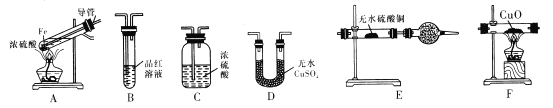
己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为______,装置E中的干燥管中盛放的物质为碱石灰,其作用是________。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
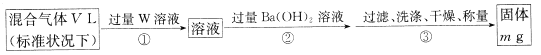
(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_______(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为______(用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)
① 欲使蛋白质从水溶液中析出而又不改变它的主要性质,应加入________(填字母)。
a. 福尔马林 b. 饱和硫酸钠溶液 c. 硫酸铜溶液
② 鉴别苯和甲苯的方法或试剂是________(填字母)。
a. 浓溴水 b. 酸化的KMnO4溶液 c. 在空气中点燃
③ 下列化合物中,常温常压呈液态的是________(填字母)。
a. 甲醇 b. 乙炔 c. 丙烯
(2) 制备聚酯玻璃钢需要下列四种物质:
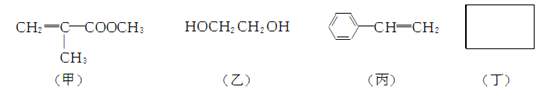
① 甲中不含氧原子的官能团是________(填名称)。
② 淀粉通过下列转化可以得到乙(其中A~D均为有机物):
 A的化学式是________,C→D的反应类型是________。
A的化学式是________,C→D的反应类型是________。
③ 丙发生加聚反应的生成物为________(写结构简式)。
④ 化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显紫色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为________。
(3) A~F的转化关系如下(已知A分子中无甲基):
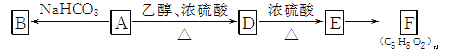
① 有机物A的相对分子质量为90,9 g A和足量Na反应,生成2.24 L H2(标准状况),则A的分子式为________。
② A缩聚生成高分子化合物的结构简式为________。
③ 由E生成F的反应类型是________。
④ 由D生成E的化学方程式为________。
⑤ 写出与A具有相同官能团的A的同分异构体的结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四组物质:①从碘的四氯化碳溶液中分离出碘;②从氯化钠和单质溴的水溶液中分离出溴;③含有水份的植物油中除去水份;④分离豆浆和豆渣.分离以上混合物的正确方法依次是( )
A.蒸馏、萃取、分液、过滤
B.萃取、蒸馏、分液、蒸发
C.萃取、蒸馏、分液、过滤
D.蒸馏、萃取、分液、蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钠(Na2S2O8)具有强氧化性,在印染、造纸和医学等方面应用广泛。利用电解制备过二硫酸钠的装置如图(a、b 均为惰性电极):下列说法正确的是

A. 过二硫酸钠中的硫呈+7价
B. 电极a是电解池的阴极
C. 电极a的电极反应式为:2SO42-+2e-=S2O82-
D. 所用离子交换膜为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明元素X的电负性比元素Y的大的是 ( )
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X单质可以把Y从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
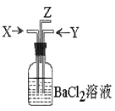
A.洗气瓶中产生的沉淀是碳酸钡 B.Z导管出来的气体中无二氧化碳
C.气瓶中产生的沉淀是硫酸钡 D.Z导管口有无色气体出现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com