
(1)①现有11g由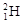 和
和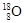 组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
②请画出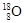 2-微粒的结构示意图: 。
2-微粒的结构示意图: 。
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为 ,分子物质的量之比为 ,所含氧原子个数之比为 。
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42—离子浓度之比为____________,SO42—离子数目之比为____________。
(4)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为 ,则含R 8.0g 的NaR的物质的量为 mol 。
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
(1)①0.5 6 5NA ②
(2)5:4 5:4 5:6 (3)1:1 2:5 (4)103g/mol 0.1 (5)0.2 0.2 2.24
解析试题分析:(1)①由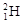 和
和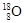 组成的水分子的摩尔质量是22g/mol,所以11g由
组成的水分子的摩尔质量是22g/mol,所以11g由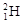 和
和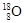 组成的水分子的物质的量=11g÷22g/mol=0.5mol。又因为质子数+中子数=质量数,所以其中含中子数为[(2-1)×2+18-8]×0.5mol=6mol。由于质子数=核外电子数,所以电子数为(1×2+8)×0.5×NA=5NA 个。
组成的水分子的物质的量=11g÷22g/mol=0.5mol。又因为质子数+中子数=质量数,所以其中含中子数为[(2-1)×2+18-8]×0.5mol=6mol。由于质子数=核外电子数,所以电子数为(1×2+8)×0.5×NA=5NA 个。
②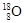 2-微粒的核外电子数是8+2=10个,所以该微粒的结构示意图为
2-微粒的核外电子数是8+2=10个,所以该微粒的结构示意图为 。
。
(2)质量相等的两种物质SO2和SO3,其物质的量之比=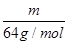 :
: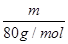 =5:4,所以两种物质中硫元素质量之比为5:4,分子物质的量之比为5:4,所含氧原子个数之比为2×5:3×4=5:6。
=5:4,所以两种物质中硫元素质量之比为5:4,分子物质的量之比为5:4,所含氧原子个数之比为2×5:3×4=5:6。
(3)0.2L 0.5mol/L Al2(SO4)3溶液中SO42—离子浓度是0.5mol/L×3=1.5mol/L,0.5L 0.5mol/L Al2(SO4)3溶液中SO42—离子浓度=0.5mol/L×3=1.5mol/L,因此所含SO42—离子浓度之比为1:1,SO42—离子数目之比为0.2L×1.5mol/L:0.5L×1.5mol/L=2:5。
(4)20.6g NaR 含有Na+0.2mol,则NaR的物质的量也是0.2mol,则其摩尔质量为20.6g÷0.2mol=103g/mol。这说明R的相对原子质量是103-23=80,则8.0gR的物质的量=8.0g÷80g/mol=0.1mol,所以含R 8.0g 的NaR的物质的量也是0.1mol 。
(5)根据反应MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑可知,镁消耗1mol二氧化锰的同时消耗4mol氯化氢,生成1mol氯气,这说明被氧化的氯化氢是2mol,所以若0.1 molMnO4与足量的浓盐酸充分反应,则有0.2mol HCl被氧化。锰元素的化合价从+4价降低到+2价,因此转移电子的物质的量为(4-2)×0.1mol=0.2mol,氯气的物质的量是0.1mol,则产生的Cl 2在标准状况下的体积为 0.1mol×22.4L/mol=2.24L。
MnCl2+2H2O+Cl2↑可知,镁消耗1mol二氧化锰的同时消耗4mol氯化氢,生成1mol氯气,这说明被氧化的氯化氢是2mol,所以若0.1 molMnO4与足量的浓盐酸充分反应,则有0.2mol HCl被氧化。锰元素的化合价从+4价降低到+2价,因此转移电子的物质的量为(4-2)×0.1mol=0.2mol,氯气的物质的量是0.1mol,则产生的Cl 2在标准状况下的体积为 0.1mol×22.4L/mol=2.24L。
考点:考查物质的量、物质的量浓度以及氧化还原反应的有关计算以及微粒结构示意图的书写


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
闪锌矿(主要成份为ZnS)是含锌主要矿物之一,空气中高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。回答下列问题(以下计算保留2位小数)
(1)取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留
固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
(2)取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(反应中只生成一种还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液中和余酸,耗用NaOH溶液的体积为21.70 mL。
①反应后溶液中多余的硫酸是____________ mol。
②通过计算确定浓硫酸被还原的产物是________________________。
(3)将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)0.5molCH4的质量是 g,在标准状况下的体积为 L;含 有约 个氢原子。
将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为 ;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)3.01×1022个OH- 的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________。
(2)相同状况下,10mL X2气体与30mL Y2气体化合生成20mL C气体,则C的化学式为_________。
(3)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,
c(Cl- ) =3.5×10-3 mol·L-1,c(NH4+) =2.3×10-3 mol·L-1, c(SO42-) =1.5×10-3
mol·L-1。则该溶液中氢离子的浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O→SO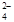 + 2Fe2+ + 4H+
+ 2Fe2+ + 4H+
Cr2O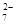 + 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ →2 Cr3+ + 6 Fe3+ + 7 H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应) 。
(2)若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为 ,制得98%的硫酸质量为 t ,SO2全部转化为H2SO4时放出的热量是 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
0.5mol H2SO4的质量是________g,含______________个分子,含________mol氧原子,能和________mol NaOH完全反应,该硫酸所含氢元素的质量与________g中所含氢元素的质量相同。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)按要求填空:
(1)以下物质:①NH3 ②CaCO3 ③酒精 ④饱和食盐水 ⑤Cu ⑥KOH ⑦HCl属于电解质的有 (填编号);
(2)14.7gH2SO4分子所含氢原子数与 L (标准状况下)NH3所含氢原子数相等;
(3)固体NaCl(I2)(括号内的物质为杂质),除去杂质的方法为 。
(4)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
| A.蒸发结晶 | B.过滤 | C.加入过量的Na2CO3溶液 | D.加水溶解 E、加入过量的烧碱溶液 F、加入过量稀盐酸 G、加入过量的Ba(NO3)2溶液 H、加入过量的稀硝酸 I、加入过量的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH 。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。生成的NaNO2为 mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2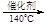 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3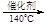 7N2 + 12H2O
7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为 (精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com