
 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | T1 |
| III | 900 | 2 | 2 | a | a | T2 |
分析 (1)根据v=$\frac{△c}{△t}$计算v(H2),再根据速率之比等于化学计量数之比计算v(CO2);
(2)A.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变;
B.容器的体积为2L,初始浓度为1mol/L,平衡时氢气浓度为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.5 0.5 0.5 0.5
平衡(mol/L):0.5 0.5 0.5 0.5
则800摄氏度下平衡常数K=$\frac{0.5×0.5}{0.5×0.5}$=1;
C.恒容条件下,反应物和产物都是气体,密度始终不变;
D.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等;
(3)实验III等效为在实验II的基础上再加入1molCO,相同温度下,增加CO浓度,CO的转化率降低;浓度越大,反应速率越快,到达平衡时间越短;
反应前后气体体积不变,用物质的量代替浓度计算900℃的平衡常数K=$\frac{0.5×0.5}{(1-0.5)×(2-0.5)}$=$\frac{1}{3}$,
实验III:CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):2 2 0 0
变化(mol):a a a a
平衡(mol):2-a 2-a a a
再根据相同温度下平衡常数不变列方程计算;
(4)c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
(5)甲醇在负极上发生氧化生成碳酸盐,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,n(CH3OH)=1mol,n(e-)=6 mol,电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%.
解答 解:(1)v(H2)=$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/(L.min),速率之比等于化学计量数之比,则v(CO2)=v(H2)=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(2)A.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变,故A错误;
B.容器的体积为2L,初始浓度为1mol/L,平衡时氢气浓度为0.5mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):1 1 0 0
变化(mol/L):0.5 0.5 0.5 0.5
平衡(mol/L):0.5 0.5 0.5 0.5
则800摄氏度下平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.5×0.5}{0.5×0.5}$=1,平衡时c(H2)=c(CO2),则n2(H2)=n(H2O)•n(CO),说明反应到达平衡,故B正确;
C.恒容条件下,反应物和产物都是气体,密度始终不变,故C错误;
D.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等,反应到达平衡,
故选:BD;
(3)实验III等效为在实验II的基础上再加入1molCO,相同温度下,增加CO浓度,CO的转化率降低;浓度越大,反应速率越快,到达平衡时间越短,则:αII(CO)>αIII(CO),T1>T2,反应前后气体体积不变,用物质的量代替浓度计算900℃的平衡常数K=$\frac{0.5×0.5}{(1-0.5)×(2-0.5)}$=$\frac{1}{3}$,
实验III:CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol):2 2 0 0
变化(mol):a a a a
平衡(mol):2-a 2-a a a
则$\frac{a×a}{(2-a)×(2-a)}$=$\frac{1}{3}$,解得a=$\sqrt{3}$-1,
故答案为:>;>;$\sqrt{3}$-1;
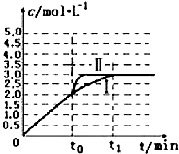
(4)c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等,故b点υ正>υ逆;
该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行,故t3~t4时刻,H2O(g)的转化率降低,
故答案为:>;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
(5)甲醇在负极上发生氧化生成碳酸盐,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,n(CH3OH)=$\frac{32g}{32g/mol}$=1mol,则n(e-)=6 mol,电流效率η=$\frac{4.5mol}{6.0mol}$×100%=75%,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;75%.
点评 本题考查化学平衡计算、平衡状态判断、化学平衡影响因素、原电池等,注意理解掌握化学平衡常数的应用.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫 氯气 | B. | 二氧化氮 二氧化硫 | ||
| C. | 氨气 二氧化碳 | D. | 氯气 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥
→合成→水热处理→过滤→水洗→表面处理→过滤水洗→干燥查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )| A. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| B. | 甲苯$\stackrel{氧化甲基}{→}$X$\stackrel{硝化}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| C. | 甲苯$\stackrel{还原}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{硝化}{→}$对氨基苯甲酸 | |
| D. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{还原硝基}{→}$Y$\stackrel{氧化甲基}{→}$对氨基苯甲酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com