
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
|
溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
|
pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,不正确的是 (填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
(1)Cl-+H2O=ClO- + H2↑
(2)① 左 ② Cl2 O2 + 4e- + 2H2O = 4OH- C ③ 阳离子交换膜
(3)bcd
【解析】
试题分析:⑶向氯水中加入NaHCO3,,碳酸氢钠与盐酸反应,氯气与水的反应正向进行,可以增大氯水中次氯酸的浓度,正确;四种溶液中,水的电离程度最大的是水解程度最大的,也就是碱性最强的,应为碳酸钠,而不是NaClO,错误;常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是应该是酸性最弱的,也就是四种盐中碱性最强的盐所对应的那种酸,即碳酸而不是亚硫酸,错误;NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(HSO3-)> c(H+) >c(SO32-)>c(OH-),错误。
考点:考查电解质溶液的有关知识。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东广州六中高一上学期期末考试化学试卷(带解析) 题型:填空题
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 、
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届广东广州六中高一上学期期末考试化学试卷(解析版) 题型:填空题
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
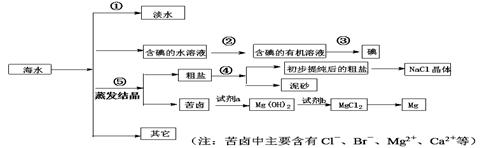
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 、
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 。
18.
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。

(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次
加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 。
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和石灰
乳制取漂白粉的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com