��2010?��ׯһģ��±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���壮
��1����Ԫ�ص�ԭ�ӽṹʾ��ͼΪ
��
��2���������ȣ�ClO
2����һ�ֹ㷺����ˮ��������������Cl
2��ȣ�ClO
2�������и�������ɱ�����������Ҳ�������������к����л��Ȼ���Ʊ�ClO
2�ķ������������֣�
2NaClO
3+4HCl=2ClO
2��+Cl
2��+2NaCl+2H
2O����
2NaClO
2+H
2O
2+H
2SO
4=2C1O
2��+O
2��+Na
2SO
4+2H
2O ����
����Ϊ���ַ������
��
��
������ţ���������
ClO2���O2����������������������
ClO2���O2����������������������
��
��3����ҵ���õ�ⱥ��ʳ��ˮ�ķ�����ȡ�ռ����������д����Ӧ�����ӷ���ʽ
��
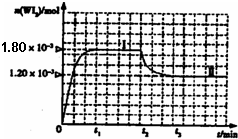
��4�����ٵƾ��бȰ׳���������һ������ܵ��ص㣮һ���¶��£������ڷ�����������ʹ�ù����г����ڹܱ��ϵ��ٿ��Է�����Ӧ��W��s��+I
2��g��
WI
2��g����Ϊģ��������Ӧ��ȷ��ȡ0.508g�⡢0.736g����������50.0mL
���ܱ������У�����ʹ�䷴Ӧ����ͼ��WI
2��g�������ʵ�����ʱ��仯��ϵͼ����������I��0��t
2ʱ��Σ��ķ�Ӧ�¶�ΪT
1������II����t
2��ʼ���ķ�Ӧ�¶�ΪT
2����T
2��T
1����
�ٸ÷�Ӧ�ġ�H
��
��
0������ڡ����ڡ���С�ڡ���
�ڴӷ�Ӧ��ʼ��t
1ʱ���ڵ�ƽ����Ӧ����v��I
2��=
��
������˵���в���ȷ����
A
A
������ţ���
A���÷�Ӧ��ƽ�ⳣ������ʽ��
K=B����˿�����¶�Խ�ߣ���˿��������WI
2Խ�ױ�ΪW�����³�������˿��
C�����ø÷�Ӧԭ�������ᴿ��
��5��25��ʱ����5mL����KCl��KIŨ�Ⱦ�Ϊ0.1mol/L�Ļ��Һ�У��μ�6mL0.1mol/L��AgNO
3��Һ�������ɵij�����
AgI
AgI
����Һ������Ũ���ɴ�С��˳����
c��K+����c��NO-3����c��Cl-����c��Ag+����c��I-��
c��K+����c��NO-3����c��Cl-����c��Ag+����c��I-��
[������H
+��OH
-��25��ʱK
SP��AgCl��=1.8��10
-10��K
SP��AgI��=8.3��10
-17]��
��6��Mg�������ᴿTi���Լ�����֪��
��Mg��s��+Cl
2��g��=MgCl
2��s����H=-641kJ/mol
��Ti��s��+2Cl
2��g��=TiCl
4��l����H=-770kJ/mol
��д��Mg��Һ̬TiCl
4��Ӧ�ᴿ�ѵ��Ȼ�ѧ����ʽ
2Mg��s��+TiCl4��1��=2MgCl2��s��+Ti��s����H=-512kJ?mol-1
2Mg��s��+TiCl4��1��=2MgCl2��s��+Ti��s����H=-512kJ?mol-1
��



 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�

 ��2010?��ׯһģ��±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���壮
��2010?��ׯһģ��±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺���о�±�ص��ʼ��仯���������Ҫ���壮
