
【题目】化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是


A. 它们之间互为同系物
B. 六星烷的化学式为C18H22
C. 三星烷与丙苯互为同分异构体,四星烷与 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种而三星烷得二氯代物有四种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳、氢元素可形成种类繁多的烃类物质。
(1)下图表示某些烃分子的模型:
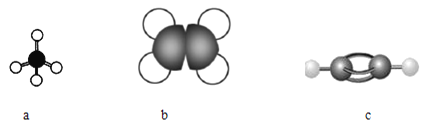
①写出a分子的空间构型______。
②c分子中的一个氢原子被![]() —取代后的物质共直线的原子最多有______个。
—取代后的物质共直线的原子最多有______个。
③取等质量的上述三种烃充分燃烧,耗氧量最大的是______(填分子式)。
④25℃和101kPa时,取a、b和c组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了56mL,原混合烃中c的体积分数为______。
(2)某烯烃的结构简式如下所示:
![]()
①用系统命名法对该烃与![]() 的加成产物命名:______,该加成产物的—氯取代物有______种。
的加成产物命名:______,该加成产物的—氯取代物有______种。
②该烯烃可以加聚生成高分子,写出该高聚物的结构简式______。该烯烃还能与乙烯以1:1比例反应形成一种环状化合物,请写出该环状化合物的键线式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化学试剂。某化学兴趣小组拟制备氮化钙并测定产品纯度。
已知:①氮化钙极易与水反应;②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验(装置可重复使用):

(1)实验室将钙保存在________中(填物质名称)。氮化钙中所含化学键类型是_________。
(2)气体从左至右,装置连接顺序为____________________________。(填代号)
(3)写出A中发生反应的化学方程式:______________________________。
(4)用化学方法检验氮化钙(Ca3N2)产品中是否混有Ca,设计实验方案:________。
Ⅱ.测定产品纯度。
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。

(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是___________________________________。
(6)取产品质量为w g,开始量气管读数为V1 mL,最终量气管读数为V2 mL(折合成标准状况),则该样品纯度为________________________(用代数式表示)。如果开始仰视刻度线,终点时俯视刻度线,则测得结果________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断正确的是( )

A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:![]()
![]() ,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
,在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:

(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为____;装置2中所加试剂为____;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为________;试管口不能向上倾斜的原因是__________。装置3中试剂为KOH,其作用为______________。
(3)反应时三颈瓶需用冷水浴冷却,其目的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示。请回答:
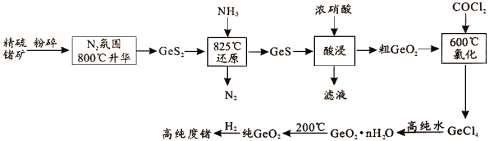
(1)锗在元素周期表中的位置是__________。
(2)800℃,在N2氛围中使精硫锗矿升华的目的是______________。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式____。酸浸时温度不能过高的原因是_____
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为_____。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。

A.冰水浴
B.冰盐水浴
C.49℃水浴
(5)请判断25℃时0.1mol·L-1NaHGeO3溶液pH________(填“>”=”或“<”)7,理由是____(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某金属氯化物MCl2 28.5 g,含有0.6 mol Cl-,则该氯化物的摩尔质量为____________,金属M的名称为____________。
(2)11.1 g CaCl2所含氯离子数与标准状况下约__________L O3所含氧原子数相等。(计算结果保留一位小数点)
(3)若a g SO2含b个原子,则阿伏加德罗常数为__________(用含a、b的公式表示)。
(4)某气体在标准状况下的密度为1.25 g/L,则 28 g该气体所含有的分子数为____________。
(5)与3.6 g水含有相同氧原子数目的硫酸的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)![]() 2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
A.v 正(B)=2v 逆(C)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中气体 B 的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.总反应方程式为2H2+O2═2H2O
C.b极反应是O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com