
【题目】将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)![]() 2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是
A.v 正(B)=2v 逆(C)B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变D.密闭容器中气体 B 的体积分数不变
【答案】D
【解析】
反应A(s)![]() 2B(g)+C(g)+D(g)的条件是恒温恒容,特点是气体减少。在此认识基础上根据化学平衡状态的定义和特征可对各选项作出判断。
2B(g)+C(g)+D(g)的条件是恒温恒容,特点是气体减少。在此认识基础上根据化学平衡状态的定义和特征可对各选项作出判断。
A. B和C的计量数之比为2:1,所以平衡时v正(B)=2v逆(C),故可判断,A选项不符合题意;
B. 该反应气体减少,恒温恒容时压强会随平衡移动而改变,所以,密闭容器中总压强不变可判断反应已经达到平衡状态,B选项不符合题意;
C. ρ=m/V,该反应体系体积不变,但气体的质量会随平衡的移动而改变,即气体的密度会随平衡的移动而改变,所以,容器中混合气体的密度不变可判断反应已经达到平衡状态,C选项不符合题意;
D. 该反应体系气体B、C、D的物质的量比值恒定,为2:1:1,即密闭容器中气体 B 的体积分数始终不变,故B 的体积分数不能用于判断反应是否达到平衡状态,D选项符合题意;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是
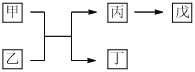
A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是


A. 它们之间互为同系物
B. 六星烷的化学式为C18H22
C. 三星烷与丙苯互为同分异构体,四星烷与 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种而三星烷得二氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为____________(填化学式)。
(2)乙与甲反应的化学方程式为____________,丙与甲反应的化学方程式为____________。
(3)D能使湿润的有色布条褪色,其褪色原因是____________(结合化学反应方程式描述原因)。
(4)D可用于制取“84”消毒液,反应的化学方程式为____________,也可用于工业上制取漂白粉,反应的化学方程式为____________,但漂白粉保存不当易变质,变质时涉及到的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中,T表示温度,n表示物质的量),根据图示得出的结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中,T表示温度,n表示物质的量),根据图示得出的结论正确的是

A. 反应速率a>b>c
B. 达到平衡时,AB3的物质的量大小为:b > c > a
C. 达到平衡时,A2的转化率大小为:b>a>c
D. 若T2>T1,则正反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)达到平衡时,测得PCl3为0.2 mol,如果此时再向容器中充入1.0 mol PCl3 和1.0 mol Cl2,在相同温度下再次达平衡时,PCl3 的物质的量是
PCl3(g)+Cl2(g)达到平衡时,测得PCl3为0.2 mol,如果此时再向容器中充入1.0 mol PCl3 和1.0 mol Cl2,在相同温度下再次达平衡时,PCl3 的物质的量是
A. 0.2 mol B. 大于0.4mol
C. 0.4 mol D. 大于0.2 mol,小于0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业中氢气可由天然气和水反应制备,其 主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:


则消耗 1molCH4 吸收或放出热量为___________________kJ(用含 a b c d 字母的代数式表示)。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,在一定条件下发生反应:NO2+CO![]() CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
①该段时间内,用 CO2 表示的平均反应速为_____________。
②假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为_________________。
③平衡时,NO2 的转化率为_________________。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_____________。
A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2
B.NO2 的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.v 正(NO)=v 逆(CO)
E.容器内压强不再发生变化
F.容器内气体的密度保持不变
G.温度和压强一定时,混合气体的颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取水煤气的反应为C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )

A.加压 B.升温 C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com