
【题目】(1)合成氨工业中氢气可由天然气和水反应制备,其 主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:


则消耗 1molCH4 吸收或放出热量为___________________kJ(用含 a b c d 字母的代数式表示)。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,在一定条件下发生反应:NO2+CO![]() CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
①该段时间内,用 CO2 表示的平均反应速为_____________。
②假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为_________________。
③平衡时,NO2 的转化率为_________________。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_____________。
A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2
B.NO2 的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.v 正(NO)=v 逆(CO)
E.容器内压强不再发生变化
F.容器内气体的密度保持不变
G.温度和压强一定时,混合气体的颜色不再发生变化
【答案】 吸热 4a+4b-2c-4d 0.05mol/(L·min) 1.5mol 40% BDG
【解析】(1)反应过程中能量变化可知:反应物的能量低于生成物,反应为吸热反应;由方程式CH4+2H2O=CO2+4H2,可知消耗 1molCH4 吸收或放出热量为4a+4b-2c-4dkJ;( 2 ) ①NO2+CO ![]() CO2+NO,2 min 时,测得容器中 NO 的物质的量为 0.2 mol ,则CO2的物质的量为0.2mol,
CO2+NO,2 min 时,测得容器中 NO 的物质的量为 0.2 mol ,则CO2的物质的量为0.2mol,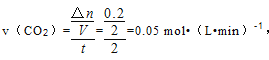 ②该反应前后体积不变,假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为 0.5mol+1mol=1.5mol;
②该反应前后体积不变,假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为 0.5mol+1mol=1.5mol;
③ NO2+CO ![]() CO2+NO,
CO2+NO,
n开始0.5mol 1mol 0 0
n变化0.2mol 0.2mol 0.2mol 0.2mol
n平衡0.3mol 0.8mol 0.2mol 0.2mol
平衡时,NO2 的转化率为0.2/0.5×100%=40%。
④达到化学平衡状态的是A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2,均为正速率,故A错误;B.NO2 的物质的量浓度不再改变是平衡状态,故B正确;C.容器内气体的平均相对分子质量在数值上= m/n ,始终是一个不变量,所以容器内气体的平均相对分子质量不变时,不一定是平衡状态,故C错误;D.v 正(NO)=v 逆(CO),NO的消耗速率等效于NO的生成速率,与CO的消耗速率相等,反应达到平衡状态,故D正确;E.两边气体化学计量数相等,容器内压强始终不随时间的变化而变化,故E错误;F. 容器内的气体反应前后遵循质量守恒,容器内气体的质量保持不变,密度不变,不一定是平衡状态,故F错误;G. 温度和压强一定时,混合气体的颜色不再发生变化,NO2 的物质的量浓度不再改变是平衡状态,故G正确;故选BDG


科目:高中化学 来源: 题型:
【题目】实验室下列物质的保存方法中,不正确的是( )
A.铝片放在不密封的容器里
B.氢氧化钠溶液盛装在用玻璃塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D.金属钠保存在石蜡油或煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼龙-66具有较高的钢性、较好的耐磨性等优良性能,广泛用于制造机械与电气装置的零件,其合成路线如下图所示。

已知: RCl+HCN ![]() RCN+HCl
RCN+HCl
完成下列填空:
(1)写出A官能团名称 ________,③的反应类型_________。
(2)写出化合物D的结构简式:_____________。
(3)写出满足下列条件C的一种同分异构体的结构简式:_________。
a.含有两种含氧官能团 b.能发生银镜反应 c.核磁共振氢谱为4组峰
(4)写出反应①②的化学方程式:_____________;____________。
(5)一定条件下,下列化合物中能与B发生化学反应的是_____。
a.NaOH b.HCl c.Na
(6)已知: ![]()
以苯为原料,选用必要的无机试剂合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
合成路线为:___________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. Kw随温度、浓度的改变而改变
B. Ksp小的难溶电解质其溶解度一定小
C. 若某吸热反应能自发进行,则该反应为熵增反应
D. 改变条件,使平衡移动,该反应的平衡常数一定改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素A和B可形成为AB2的离子化合物,则A、B两原子的外围电子排布分别为( )
A. ns2np2和ns2np4 B. ns1和ns2np4
C. ns2和ns2np5 D. ns1和ns2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断正确的是
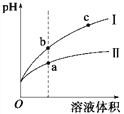
A. Ⅱ为盐酸稀释时的pH变化曲线
B. 溶液的导电性: a > b > c
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合后,不会发生离子反应的是( )
A.Na2SO4溶液和MgCl2 溶液 B.Na2CO3溶液和稀硫酸
C.NaOH溶液和Fe2(SO4)3溶液 D.Ca(OH)2和盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
(1)Q+核外电子排布式为___________;
(2)化合物X2W2中W的杂化方式为___________,ZW2-离子的立体构型是___________;
(3)Y、R的最高价氧化物的沸点较高的是___________(填化学式),原因是___________;
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________;
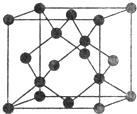
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为___________,Y原子的配位数为___________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为___________(用含a和ρ的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com