
【题目】尼龙-66具有较高的钢性、较好的耐磨性等优良性能,广泛用于制造机械与电气装置的零件,其合成路线如下图所示。

已知: RCl+HCN ![]() RCN+HCl
RCN+HCl
完成下列填空:
(1)写出A官能团名称 ________,③的反应类型_________。
(2)写出化合物D的结构简式:_____________。
(3)写出满足下列条件C的一种同分异构体的结构简式:_________。
a.含有两种含氧官能团 b.能发生银镜反应 c.核磁共振氢谱为4组峰
(4)写出反应①②的化学方程式:_____________;____________。
(5)一定条件下,下列化合物中能与B发生化学反应的是_____。
a.NaOH b.HCl c.Na
(6)已知: ![]()
以苯为原料,选用必要的无机试剂合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
合成路线为:___________________________________________________________________
【答案】 碳碳双键 氯原子 缩聚反应 (聚合反应) NH4OOC(CH2)4﹣COONH4 ![]()
![]()
![]() b c
b c ![]()
【解析】结合题目信息再采用逆推法,E与C发生缩骤反应生成尼龙-66,由尼龙-66的结构简式可推知C为HOOC-(CH2)4-COOH,E为H2N-(CH2)6-NH2,1,3-丁二烯与氯气发生1,4-加成得A为CH2Cl-CH=CH-CH2Cl,A与HCN发生取代反应生成NCCH2CH=CHCH2CN,NCCH2CH=CHCH2CN与氢气加成得E,对比B的分子式可知,环已烷被氧化生成B为![]() ,B被氧化生成环已酮,环已酮与硝酸反应生成C,C与氨气反应生成D为NH4OOC(CH2)4-COONH4,D脱去水得NCCH2CH2CH2CH2CN;
,B被氧化生成环已酮,环已酮与硝酸反应生成C,C与氨气反应生成D为NH4OOC(CH2)4-COONH4,D脱去水得NCCH2CH2CH2CH2CN;
(1)有机物CH2Cl-CH=CH-CH2Cl含有的官能团名称碳碳双键和氯原子,③的反应是HOOC-(CH2)4-COOH和H2N-(CH2)6-NH2发生缩聚反应 (聚合反应)生成尼龙-66;
(2)化合物D的结构简式为NH4OOC(CH2)4-COONH4;
(3)a.含有两种含氧官能团可能是羧基,也可能是酯基或醛基等;b.能发生银镜反应说明有醛基;c.核磁共振氢谱为4组峰,说明结构相对对称性较强,满足下列条件C的一种同分异构体的结构简式为![]() ;
;
(4)反应①的化学方程式为![]() ;②的化学方程式为
;②的化学方程式为![]() ;
;
(5)B为![]() 具有醇的性质,则能与HCl发生取代反应生成卤代烃,能与Na反应生成氢气,没有酚的性质,不能与NaOH反应,故答案为bc;
具有醇的性质,则能与HCl发生取代反应生成卤代烃,能与Na反应生成氢气,没有酚的性质,不能与NaOH反应,故答案为bc;
(6)以苯为原料合成![]() ,可以用苯与氯气发生取代,再碱性水解、酸化,再与氢气加成可得,合成路线为
,可以用苯与氯气发生取代,再碱性水解、酸化,再与氢气加成可得,合成路线为![]() 。
。


科目:高中化学 来源: 题型:
【题目】Ⅰ.甲烷—空气燃料电池若以KOH溶液为电解质溶液,负极的电极反应式为______________;若以稀硫酸为电解质溶液,正极的电极反应式为 __________________________。
Ⅱ.现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:__________________,正极:___________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)________。

该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的数目是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 丙烷没有同分异构体
B. CH(CH3)2CH2CH2CH3 的一氯代物有4种
C. 二氯苯有3种,则四氯苯有6种
D. CH3OH与CH2OH-CH2OH都属于醇,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
B | 探究淀粉的水解程度 | 试管、烧杯、酒精灯 | 淀粉溶液、银氨溶液 |
C | 探究石蜡油分解产物是否含有不饱和烃 | 硬质试管、酒精灯,铁架台、导管 | 石蜡油、碎瓷片、酸性高锰酸钾溶液 |
D | 测定NaOH溶液浓度 | 酸式滴定管、碱性滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol/L盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸铁溶液中,加入ag铜完全溶解后再加入bg铁,充分反应后得到cg残余固体,且a>c,则下列说法中正确的是( )
A.残余固体可能为铁和铜的混合物
B.最后得到的溶液可能含有Fe3+
C.残余固体是铁,溶液中一定不含Cu2+
D.残余固体一定全部是铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
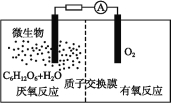
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
_______________________________________________________。
(2)光气(COCl2)是一种重要化工原料,常用于聚酯类材料的生产,工业上通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图1为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=_______;
②该反应第一次达平衡时的平衡常数为__________,10min改变的条件是______。
(3)利用氨水可以将SO2和NO2吸收,原理如图2所示:NO2被吸收的离子方程式是___________________________________。

(4)以甲醇燃料电池为电源,粗硅为原料,熔融盐电解法制取硅烷原理如图3,判断A为电源的___极,电解时阳极的电极反应式为_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业中氢气可由天然气和水反应制备,其 主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示:


则消耗 1molCH4 吸收或放出热量为___________________kJ(用含 a b c d 字母的代数式表示)。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,在一定条件下发生反应:NO2+CO![]() CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
CO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则:
①该段时间内,用 CO2 表示的平均反应速为_____________。
②假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为_________________。
③平衡时,NO2 的转化率为_________________。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_____________。
A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2
B.NO2 的物质的量浓度不再改变
C.容器内气体的平均相对分子质量不变
D.v 正(NO)=v 逆(CO)
E.容器内压强不再发生变化
F.容器内气体的密度保持不变
G.温度和压强一定时,混合气体的颜色不再发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com