
【题目】Ⅰ.甲烷—空气燃料电池若以KOH溶液为电解质溶液,负极的电极反应式为______________;若以稀硫酸为电解质溶液,正极的电极反应式为 __________________________。
Ⅱ.现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱。
(1)写出电极反应式,负极:__________________,正极:___________________。
(2)请在下面方框中画出原电池的装置图,标出外电路电子流向(注明电极材料、电解质溶液,连成闭合回路)________。

该装置反应一段时间后,当溶液的质量增加3.2 g时,通过导线的电子的数目是_________。
【答案】 CH4+10OH--8e-=CO32-+7H2O O2+4e-+4H+=2H2O Cu -2e-= Cu2+ 2Fe3++2e-=2Fe2+ 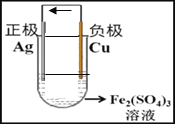 0.1NA
0.1NA
【解析】试题分析:Ⅰ. 碱性甲烷燃料电池,总反应为![]() ,甲烷失电子发生氧化反应,为电池负极;若以稀硫酸为电解质溶液,总反应是
,甲烷失电子发生氧化反应,为电池负极;若以稀硫酸为电解质溶液,总反应是![]() ,氧气在电极正极得电子发生还原反应。
,氧气在电极正极得电子发生还原反应。
Ⅱ.氧化性Cu2+<Fe3+,要证明Cu2+<Fe3+,根据氧化剂氧化性大于氧化产物,需要发生![]() ;
;
该装置反应一段时间后,溶液的质量增加3.2 g,说明有3.2g铜参加反应。
解析:Ⅰ. 甲烷—空气燃料电池若以KOH溶液为电解质溶液,总反应为![]() ,甲烷失电子发生氧化反应,为电池负极,负极的电极反应为CH4+10OH--8e-=CO32-+7H2O;若以稀硫酸为电解质溶液,总反应是
,甲烷失电子发生氧化反应,为电池负极,负极的电极反应为CH4+10OH--8e-=CO32-+7H2O;若以稀硫酸为电解质溶液,总反应是![]() ;若以稀硫酸为电解质溶液,正极是氧气得电子发生还原反应,电极反应式为 O2+4e-+4H+=2H2O。
;若以稀硫酸为电解质溶液,正极是氧气得电子发生还原反应,电极反应式为 O2+4e-+4H+=2H2O。
Ⅱ.氧化性Cu2+<Fe3+,要证明Cu2+<Fe3+,根据氧化剂氧化性大于氧化产物,需要发生![]() ,选择纯银片、纯铜片, Fe2(SO4)3溶液、大烧杯、导线若干组成原电池。(1)铜是负极电极反应式,Cu -2e-= Cu2+,正极是铁离子得电子生成亚铁离子:2Fe3++2e-=2Fe2+。
,选择纯银片、纯铜片, Fe2(SO4)3溶液、大烧杯、导线若干组成原电池。(1)铜是负极电极反应式,Cu -2e-= Cu2+,正极是铁离子得电子生成亚铁离子:2Fe3++2e-=2Fe2+。
(2) 。
。
溶液的质量增加3.2 g,说明有3.2g铜参加反应,转移电子的物质的量xmol
根据

![]()
X=0.1mol,转移电子的数目是0.1NA


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将下列各种液体:①苯;② 四氯化碳;③碘化钾溶液;④乙烯;⑤植物油,分别与溴水混合后充分振荡、静置,液体分为两层,原溴水层几乎是无色的是
A.②⑤ B.只有②④
C.①②④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、 C、D是原子序数依次增大的五种短周期主族元素。B、C、E最外层电子数之和为11;A 原子核外最外层电子数是次外层的2倍;C是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备D的单质;E单质是制备太阳能电池的重要材料。下列说法正确的是( )
A. 简单离子半径:B>C
B. 最高价氧化物对应水化物的酸性: A<E
C. 工业上不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 相同质量的C和D单质分别与足量稀盐酸反应,前者生成的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( ) ①NaHCO3②Al2O3③Al(OH)3④Al.
A.③④
B.②③④
C.①③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.SiO2熔点高,可用作光导纤维
B.Li还原性强且质轻,常用作负极材料
C.Fe2(SO4)3具有氧化性,能用作净水剂
D.SO2能杀菌,可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室下列物质的保存方法中,不正确的是( )
A.铝片放在不密封的容器里
B.氢氧化钠溶液盛装在用玻璃塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D.金属钠保存在石蜡油或煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尼龙-66具有较高的钢性、较好的耐磨性等优良性能,广泛用于制造机械与电气装置的零件,其合成路线如下图所示。

已知: RCl+HCN ![]() RCN+HCl
RCN+HCl
完成下列填空:
(1)写出A官能团名称 ________,③的反应类型_________。
(2)写出化合物D的结构简式:_____________。
(3)写出满足下列条件C的一种同分异构体的结构简式:_________。
a.含有两种含氧官能团 b.能发生银镜反应 c.核磁共振氢谱为4组峰
(4)写出反应①②的化学方程式:_____________;____________。
(5)一定条件下,下列化合物中能与B发生化学反应的是_____。
a.NaOH b.HCl c.Na
(6)已知: ![]()
以苯为原料,选用必要的无机试剂合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
合成路线为:___________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com