
【题目】已知次氯酸分子的结构式为H﹣O﹣Cl,下列有关说法正确的是( )
A.该分子的电子式是H:O:Cl
B.O原子与H、Cl都形成σ键
C.该分子为直线型分子
D.O原子发生sp杂化
【答案】B
【解析】
试题分析:A、次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构;
B、共价单键为σ键;
C、HClO中O的价层电子对数为4,孤电子对数为2,空间构型为V型;
D、依据价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() ×(a﹣xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数分析解答.
×(a﹣xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数分析解答.
A、H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为![]() ,故A错误;
,故A错误;
B、从次氯酸的结构式可以看出含有O﹣H、O﹣Cl,共价单键为σ键,故B正确;
C、HClO中O价层电子对数为4,孤电子对数为2,空间构型为V型,故C错误;
D、HClO中O原子形成2个σ键,孤电子对个数=![]() ×(6﹣2×1)=2,价层电子对数为4,为sp3杂化,故D错误;
×(6﹣2×1)=2,价层电子对数为4,为sp3杂化,故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】(1)某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
①Na2O2的电子式为 ,它与水反应的离子方程式是 。
②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂______ (填化学式),有气体产生。
(2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
由此可以推断:
溶液中肯定存在的离子有 。溶液中不能确定是否存在的离子有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)反应aA(g)+bB(g)![]() cC(g) △H<0在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g) △H<0在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示:
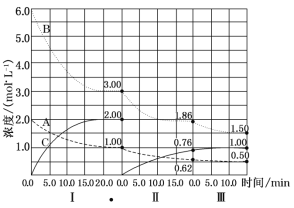
(1)反应的化学方程式中,a:b:c为_______;
(2)由第一次平衡到第二次平衡,改变的条件是__________;
(3) 由第二次平衡到第三次平衡,改变的条件是_________;
(4)第II阶段B的平衡转化率aII(B)=_______________;
(5)三次平衡时平衡常数KI、KII、KIII的大小顺序为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关概念的说法正确的是( )
A.H2、D2、T2互为同素异形体
B.甲烷和异丁烷互为同系物
C.14C和C60互为同位素
C.淀粉和纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.因为Na2CO3+SiO2![]() Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强
B.碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似
C.二氧化硅溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物
D.二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不和水反应生成硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 2molL﹣1的盐酸跟过量的锌反应,为加快反应速率,可采用的方法是( )
A.改用适量的6molL﹣1的盐酸 B.加入数滴氯化铜溶液
C.加入适量MnO2 D.加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用下图装置进行实验研究(a、b、c表示止水夹)。请评价或完善其方案:
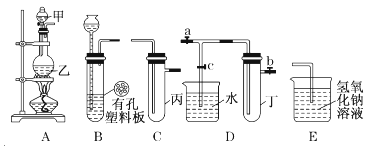
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为 。
②A中反应的离子方程式: 。
③E中氢氧化钠溶液的作用 。
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
实验序号 | 实验操作 | 现象 | 结论 |
Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
④实验Ⅰ推出的相应结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
⑤实验Ⅱ推出相应的结论是否合理? ,若不合理,请说明理由(若合理,无需填写) 。
(2)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2。B中反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C (s)+H2O (g) ![]() CO(g)+H2(g) ΔH = +131.4 kJ/mol
CO(g)+H2(g) ΔH = +131.4 kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为_________________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如下图),在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率随时间的变化:(用实线表示)

①缩小容器体积,t2时到达平衡;②t3时平衡常数K值变大,t4到达平衡。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com