
【题目】“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C (s)+H2O (g) ![]() CO(g)+H2(g) ΔH = +131.4 kJ/mol
CO(g)+H2(g) ΔH = +131.4 kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密度增大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为_________________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如下图),在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率随时间的变化:(用实线表示)

①缩小容器体积,t2时到达平衡;②t3时平衡常数K值变大,t4到达平衡。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,1 mol液态水变成气态水吸热44.0 kJ,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。

【答案】(1)0.002 mol ∕ L·min;(2)AC;
(3)如图: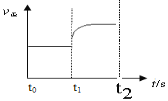
 ;
;
(4)CH3OH (l)+O2 (g) =CO (g)+2H2O (g) ΔH=-354.8 kJ ∕ mol;
(5)2Cu2++2H2O![]() 2Cu+O2+4H+,34.8。
2Cu+O2+4H+,34.8。
【解析】
试题分析:(1)因为是等体积,因此密度增大了0.12g·L-1,气体质量增大了3×0.12g=0.36g,根据质量差,求出消耗的H2O的物质的量0.36/12mol=0.03mol,v(H2O)=0.03/(3×5)mol/(L·min)=0.002 mol/(L·min);(2)A、根据化学平衡状态的定义,CO的含量保持不变,说明反应达到平衡,故正确;B、反应方向都是向正反应方向进行,要求是一正一逆,故错误;C、根据摩尔质量的定义,气体的质量增大,气体的物质的量增大,因此摩尔质量不变,说明反应达到平衡,故正确;(3)①缩小容器的体积,增大压强,根据勒夏特列原理,平衡向逆反应方向移动,图像是: ;②平衡常数增大,只改变温度,说明化学反应向正反应方向移动,此反应是吸热反应,因此升高温度,图像是:
;②平衡常数增大,只改变温度,说明化学反应向正反应方向移动,此反应是吸热反应,因此升高温度,图像是: ;(4)①CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1,②CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1,③H2O(l)=H2O(g) △H=+44.0kJ·mol-1,CH3OH+O2=CO+2H2O(g),①-②+2×③得出:CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=(-725.8+283+2×44)kJ·mol-1=-354.8kJ·mol-1;(5)甲池为原电池,乙池、丙池为电解池,通甲醇的一极为负极,通氧气的一极为正极,乙池中石墨跟电池的正极相连,即石墨为阳极,Ag作阴极,因此电极总反应式是:2Cu2++2H2O
;(4)①CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8kJ·mol-1,②CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1,③H2O(l)=H2O(g) △H=+44.0kJ·mol-1,CH3OH+O2=CO+2H2O(g),①-②+2×③得出:CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H=(-725.8+283+2×44)kJ·mol-1=-354.8kJ·mol-1;(5)甲池为原电池,乙池、丙池为电解池,通甲醇的一极为负极,通氧气的一极为正极,乙池中石墨跟电池的正极相连,即石墨为阳极,Ag作阴极,因此电极总反应式是:2Cu2++2H2O![]() 2Cu+O2+4H+,甲池反应方程式为CH3OH+3/2O2+2KOH=K2CO3+3H2O,甲池溶液增重的质量为甲醇和氧气的质量,设甲醇的物质的量为xmon,则氧气的物质的量为3x/2mol,因此有32x+3×32x/2=16,解得x=0.2mol,整个电路中通过电子的物质的量为0.2×6mol=1.2mol,丙池中沉淀:Mg+2OH--2e-=Mg(OH)2,m[Mg(OH)2]=1.2×58/2g=34.8g。
2Cu+O2+4H+,甲池反应方程式为CH3OH+3/2O2+2KOH=K2CO3+3H2O,甲池溶液增重的质量为甲醇和氧气的质量,设甲醇的物质的量为xmon,则氧气的物质的量为3x/2mol,因此有32x+3×32x/2=16,解得x=0.2mol,整个电路中通过电子的物质的量为0.2×6mol=1.2mol,丙池中沉淀:Mg+2OH--2e-=Mg(OH)2,m[Mg(OH)2]=1.2×58/2g=34.8g。


科目:高中化学 来源: 题型:
【题目】已知次氯酸分子的结构式为H﹣O﹣Cl,下列有关说法正确的是( )
A.该分子的电子式是H:O:Cl
B.O原子与H、Cl都形成σ键
C.该分子为直线型分子
D.O原子发生sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A. a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点时c(NH4+)+c(NH3·H2O)=c(Cl-)
C. c点时消耗的盐酸体积:V(HCl)<20.00mL
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,能完成很多电化学实验。下列有关此装置的叙述中,错误的是( )

A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流的阴极保护法
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处时,铁电极上的电极反应式为:Cu2++2e-===Cu
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处时溶液中各离子浓度都不会发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时负极反应为:3Zn-6e-+6OH-==3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-![]() FeO42- +4H2O
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质一定互为同系物的是
A. C4H8和C5H10 B. C3H8和C4H10
C. C2H4O2和C3H6O2 D. C6H5OH和C6H5CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙酸是弱酸的实验事实是
A.CH3COOH溶液与Zn反应放出H2
B.0.1 mol/L CH3COONa溶液的pH大于7
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)收集氨气时,可采用向 (填“上”或“下”)排空气法;
(2)下列四组实验装置常用于物质的分离和提纯.
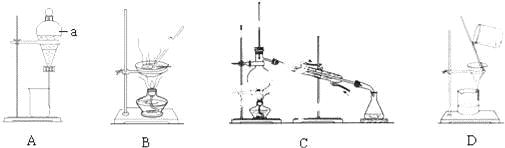
①A中仪器a的名称为 ;
②若要通过蒸馏的方法淡化海水,应选择的装置为 (填装置代号,下同);③若要从食盐溶液中得到食盐晶体,应选择的装置为 ;www-2-1-cnjy-com
④若要除去食盐水中不溶性的泥沙等杂质,应选择的装置为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com