
����Ŀ�������£���1��000mol/L�������20��00mL1��000mol/L��ˮ�У���ҺpH���¶��������������仯��������ͼ��ʾ�������й�˵����ȷ����

A. a����ˮ�������c��H������1��0��10��14mol/L
B. b��ʱc��NH4������c��NH3��H2O����c��Cl����
C. c��ʱ���ĵ����������V��HCl��<20��00mL
D. d�����Һ�¶����½�����Ҫԭ����NH3��H2O��������
���𰸡�C
�����������������A����a��7��pH��14�����ˮ�������c��H+����1��0��10-14molL-1��A����B������Ͱ�ˮ��Ӧ����Һ�����ԣ���c��H+��=c��OH-�������ݵ���غ��֪c��Cl-��=c��NH4+����b��ʱpH��7����ˮ������c��NH4+��+c��NH3H2O����c��Cl-����B����C��C����Һ�����ԣ���c��H+��=c��OH-�����Ȼ����ǿ�������Σ���ˮ��Һ�����ԣ�Ҫʹ��ˮ��Һ�����ԣ���ˮӦ��������������������������V��HCl����20��00mL��C��ȷ��D��d��ʱ����Ͱ�ˮǡ����ȫ��Ӧ��������࣬�ټ������¶Ƚ���ֻ���Ǽ���������¶ȵ�����Һ�¶ȣ�������¶��½���ԭ��D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(10��)��ӦaA(g)+bB(g)![]() cC(g) ��H<0�ڵ��������½��С��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
cC(g) ��H<0�ڵ��������½��С��ı�������Ӧ��������I��II��III����ϵ�и�����Ũ����ʱ��仯��������ͼ��ʾ��
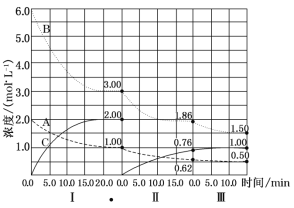
��1����Ӧ�Ļ�ѧ����ʽ�У�a:b:cΪ_______��
��2���ɵ�һ��ƽ��ڶ���ƽ�⣬�ı��������__________��
��3�� �ɵڶ���ƽ�������ƽ�⣬�ı��������_________��
��4����II��B��ƽ��ת����aII(B)=_______________��
��5������ƽ��ʱƽ�ⳣ��KI��KII��KIII�Ĵ�С˳��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100mL 2molL��1�������������п��Ӧ��Ϊ�ӿ췴Ӧ���ʣ��ɲ��õķ����ǣ� ��
A������������6molL��1������ B�����������Ȼ�ͭ��Һ
C����������MnO2 D�������������Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ����ͼװ�ý���ʵ���о�(a��b��c��ʾֹˮ��)�������ۻ������䷽����
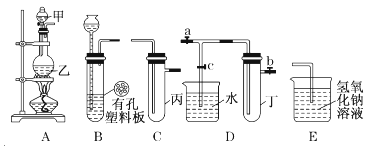
��1����װ��A��C��E�����ӣ���MnO2��Ũ������ȡ��������ش�
����Ԫ�������ڱ��е�λ��Ϊ ��
��A�з�Ӧ�����ӷ���ʽ�� ��
��E������������Һ������ ��
��C�м���������ˮ���Ƶ���ˮ����������ˮ�ֳ����ݽ���ʵ�飬�����������ͽ���Ϊ��
ʵ����� | ʵ����� | ���� | ���� |
�� | ����ˮ����Ʒ����Һ | Ʒ����Һ��ɫ | ������Ư���� |
�� | ��ˮ�м���̼�����Ʒ�ĩ | ����ɫ���ݲ��� | ������ˮ��Ӧ�IJ���������� |
��ʵ�����Ƴ�����Ӧ�����Ƿ������ ��������������˵�����ɣ���������������д�� ��
��ʵ�����Ƴ���Ӧ�Ľ����Ƿ������ ��������������˵�����ɣ���������������д�� ��
��2����B��D��E��������B��װŨ�����ͭƬ�����Ƶ�NO2��B�з�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӳ֬���������������Ӧ�õ�Ӳ֬���ƺ��͡��������Ӳ֬���ƣ�Ӧ���õķ����ǣ�������ֽ���� ���÷�Һ©����Һ ���������� �������ȵı���ʳ��ˮ
A���ܢ� B���ܢ� C���٢� D���ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ��������������ȷ����
A�����³�ѹ�£�17g��(��14CH3)������������Ϊ8NA
B��0.1molFe��0.1molCl2��ַ�Ӧ��ת�Ƶĵ�����Ϊ0.2NA
C����״���£�44.8LNO��22.4LO2��Ϻ�����ķ�������Ϊ2NA
D��1molNa2O��Na2O2�����������������������3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�ѧ����ʽ�е���Hʵ����������ѧ�е�һ���������������ʱ䣬����ֵ�ͷ����뷴Ӧ�����������������йأ�Ҳ�뷴Ӧ���������ļ����йء�
(1)����ͼ����ʾ��ʾ����NO2��CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��________________________��

(2)ͼ����ʾ����Ԫ���е��������������������⻯��ʱ���ʱ����ݣ������ʱ����ݿ�ȷ��a��b��c��d�ֱ��������Ԫ�أ���д��������������ѧ��̬�£������ֽⷴӦ���Ȼ�ѧ����ʽ��__________________��
(3)��֪��
��Fe2O3(s)��3CO(g)===2Fe(s)��3CO2(g)����H����25 kJ��mol��1��
��3Fe2O3(s)��CO(g)===2Fe3O4(s)��CO2(g)����H����47 kJ��mol��1��
��Fe3O4(s)��CO(g)===3FeO(s)��CO2(g)����H��19 kJ��mol��1
��д��CO��ԭFeO���Ȼ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ྻú�������о����������൱�ձ飬������Աͨ�������ú������¯�н�����������ˮ�����ķ��������������˸���ֵ��ú̿��������Ҫ�ɷ���CO��H2��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺������ú̿���ķ�Ӧ֮һ�ǣ�C (s)��H2O (g) ![]() CO(g)��H2(g) ��H = ��131.4 kJ/mol
CO(g)��H2(g) ��H = ��131.4 kJ/mol
��1�����ݻ�Ϊ3 L���ܱ������з���������Ӧ��5 min��������������ܶ�������0.12 g/L����H2O��ʾ0 ~ 5 min��ƽ����Ӧ����Ϊ_________________________��
��2������������Ӧ�ڻ�ѧƽ��״̬ʱ��������ȷ���� ��
A��CO�ĺ������ֲ���
B��v��(H2O)= v��(H2)
C�������л�������ƽ����Է����������ֲ���
��3����������Ӧ��t0ʱ�̴ﵽƽ��(����ͼ)����t1ʱ�̸ı�ijһ������������ͼ�м�������t1ʱ��֮������Ӧ������ʱ��ı仯������ʵ�߱�ʾ��

����С���������t2ʱ����ƽ�⣻��t3ʱƽ�ⳣ��Kֵ���t4����ƽ�⡣
��4����һ����������CO��H2�����Ƶü״���CH3OH��CO��ȼ����Ϊ��725.8 kJ/mol ��283.0 kJ/mol��1 molҺ̬ˮ�����̬ˮ����44.0 kJ��д���״�����ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ����ʽ�� ��
��5������ͼ��ʾ���Լ״�ȼ�ϵ����Ϊ��Դʵ�����е����̡��ҳ��з�����Ӧ�����ӷ���ʽΪ �����׳�������16 gʱ�������������ϲ����������������ֵΪ g��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.2 mol��L��1��һԪ��HA���Ũ��NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ����(����)

A. HAΪǿ��
B. �û����ҺpH��7.0
C. �û����Һ�У�c(A��)��c(Y)��c(Na��)
D. ͼ��X��ʾHA��Y��ʾOH����Z��ʾH��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com