
【题目】(CH3CH2)2CHCH3的正确命名是( )
A.2-乙基丁烷B.2-甲基戊烷C.3-乙基丁烷D.3-甲基戊烷
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为__________________;
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为_____________mol;
(3)如果盐酸过量,生成CO2的体积为______________L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道_______________;
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“苏丹红一号”(结构如下图所示)是一种合成染料,科学家通过经毒理学研究,发现长期食用含有苏丹红的食品对人体可能有致癌因素。下列关于“苏丹红一号”的说法中不正确的是

A. 属于芳香族化合物,分子式为C16H12N2O
B. 分子中的所有原子可能位于同一平面上
C. 分子中苯环上的一取代物共有11种
D. 能与NaOH溶液、FeCl3溶液、溴水等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下,下列说法不正确的是
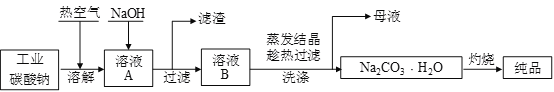
A. 步骤①,通入热空气可以将Fe2+氧化
B. 步骤②,产生滤渣的主要成分为Mg(OH)2和 Fe(OH)3
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3·H2O中混有Na2CO3·10H2O等杂质
D. 步骤④,灼烧Na2CO3·H2O在瓷坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
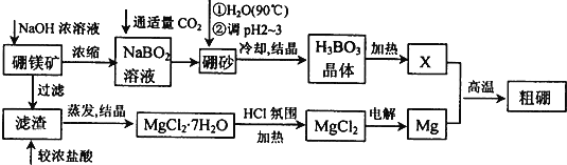
回答下列有关问题:
(1)硼砂中B的化合价为________________,溶于热水后,常用H2SO4调pH为2~3制取H3BO3,反应的离子方程式为________________________________________________________________。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_______________________________________________________________。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是______________________________________________________________。若用惰性电极电解MgCl2溶液,其总反应离子方程式为____________________________________________________________。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则正极反应式为____________________________________________________。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定至终点,并选用指示剂,达到滴定终点的现象是_________________________________________。消耗Na2S2O3溶液18.00mL。该粗硼样品的纯度为__________________。(提示:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,可用于化肥、灭火剂、洗涤剂等。某研究小组用下图所示的实验装置,利用氢氧化钠固体、浓氨水、干冰等作原料制备氨基甲酸铵。主要反应原理:2NH3(g) + CO2(g)=H2NCOONH4(s) ΔH<0。
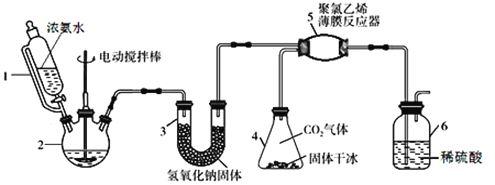
(1)实验室用98%的浓硫酸配制15%的稀硫酸,除量筒外还需使用下列仪器中的____。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)仪器1恒压分液漏斗,其优点是__________________________。
(3)仪器3中NaOH固体的作用是__________________________。
(4)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内稀硫酸溶液中产生气泡,应该______(填“加快”、“减慢”或“不改变”)产生氨气的流速。
(5)另有一种制备氨基甲酸铵的反应器(CCl4与液体石蜡均为惰性介质)如图。生成的氨基甲酸铵小晶体悬浮在四氯化碳中,当悬浮物较多时,停止制备。
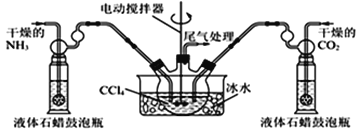
①发生器用冰水冷却的原因是________________________________________;
②从反应后混合物中过滤分离出产品。为了得到干燥产品,应采取的方法是_____(填序号)
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
(6)已知氨基甲酸铵可完全水解,其中产物有碳酸氢铵。氨基甲酸铵水解反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂2molH—H键
C. 混合气体分子的总数不变
D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:转化率=某一反应物转化的量÷该反应物的初始量×100%。在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t4时刻,该反应处于化学平衡状态
B. t3时,A的转化率比B的转化率高
C. t1至t2时刻,该反应的速率为3 mol·L-1 s-1
D. 该反应的化学方程式是:2A(g)+B(g)![]() C(g)
C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=c(FeO)c(CO)/c(Fe)c(CO2)
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com