
【题目】现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为__________________;
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为_____________mol;
(3)如果盐酸过量,生成CO2的体积为______________L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道_______________;
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是________________________________。
【答案】100 : 84![]()
![]() 盐酸的物质的量浓度
盐酸的物质的量浓度![]()
【解析】
(1)该混合物中NaHCO3与KHCO3的物质的量之比为![]() ;
;
(2) NaHCO3的物质的量=![]() , KHCO3的物质的量
, KHCO3的物质的量![]() ,混合物与100mL盐酸恰好反应,碳酸氢盐与盐酸按1:1反应,则n(HCl)=n(NaHCO3)+ n(KHCO3)=
,混合物与100mL盐酸恰好反应,碳酸氢盐与盐酸按1:1反应,则n(HCl)=n(NaHCO3)+ n(KHCO3)= ![]() ;
;
(3)盐酸过量, NaHCO3和KHCO3组成的混合物完全反应,根据碳元素守恒可以知道, n(HCl)=n(NaHCO3)+ n(KHCO3)= ![]() ,所以标准状况下生成CO2的体积为
,所以标准状况下生成CO2的体积为![]() ;
;
(4)碳酸氢盐与盐酸按1:1反应,盐酸不足量,碳酸氢盐有剩余,应根据HCl的物质的量计算二氧化碳的体积,所以要计算生成CO2的体积,还需要知道盐酸的物质的量浓度;
(5)假定碳酸氢盐全是NaHCO3,则n(NaHCO3)= ![]() , NaHCO3完全反应,根据碳元素守恒,可以知道生成二氧化碳n(CO2)= n(NaHCO3)=
, NaHCO3完全反应,根据碳元素守恒,可以知道生成二氧化碳n(CO2)= n(NaHCO3)= ![]() ;假定碳酸氢盐全是KHCO3,则n(KHCO3)=
;假定碳酸氢盐全是KHCO3,则n(KHCO3)= ![]() , KHCO3完全反应,根据碳元素守恒,可以知道生成二氧化碳n(CO2)= n(NaHCO3)=
, KHCO3完全反应,根据碳元素守恒,可以知道生成二氧化碳n(CO2)= n(NaHCO3)= ![]() ,所以实际二氧化碳的物质的量为
,所以实际二氧化碳的物质的量为![]() ,故标况下
,故标况下![]() 。
。
,


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】(1)1mol H2SO4中含_____mol O 。4mol NH4NO3与______ mol H2SO4所含氧原子数相同。1.204×1024个Mg变成Mg2+失去____ mol eˉ。
(2)4.5g水与___________ g硫酸所含的分子数相等。
(3)乙醇(C2H6O)水溶液中,当乙醇分子和水分子中氢原子个数相等时,溶液中乙醇的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住0.78 g Na2O2粉末,置于石棉网上,往脱脂棉上滴1 mL水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象可得出的结论是:Na2O2与H2O反应有氧气生成且反应为________反应。
(2)如果用嘴通过细管向脱脂棉中吹气,脱脂棉也能燃烧起来,试写出反应的化学方程式___________;若向脱脂棉中吹入的是SO2气体,脱脂棉________(填“能”或“不能”)燃烧起来。
(3)H2和CO的混合气体0.02 g通入一盛有0.78 g Na2O2的密闭容器中,再通入过量O2,并用电火花引燃使其充分反应,容器中固体增加的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列合成路线合成镇痛药芬太尼:
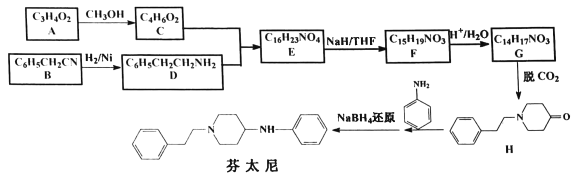
已知:![]()
请回答:
(1)化合物C的结构简式是________。
(2)下列说法正确的是_________。
A.B→D的反应类型为加成反应
B.F和G都能与碳酸氢钠溶液反应
C.芬太尼的分子式为C19H23N2
D.将A→C过程中的CH3OH改为C2H5OH,对芬太尼的结构无影响
(3)写出E→F的化学方程式__________________。
(4)写出符合下列条件的H的所有同分异构体________。
①含有![]() ②含
②含![]() 结构,且此环上无其它支链
结构,且此环上无其它支链
③苯环上的一氯代物只有2种
(5)已知: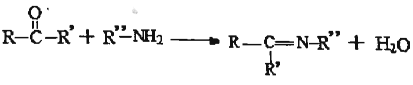 ,设计以环己酮(
,设计以环己酮(![]() )和苯胺(
)和苯胺(![]() )为原料合成有机物
)为原料合成有机物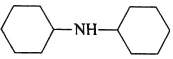 (用流程图表示,其他无机试剂任选)。_____
(用流程图表示,其他无机试剂任选)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L (标准状况)。
(1)则选用所贴标签为2.0mol·L-1的氢氧化钠,至少需该氢氧化钠多少毫升?
_________________
(2)如选用所贴标签为7%(密度为1.043g·mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸多少毫升?
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故或药品的处理正确的是( )
A.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
B.当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。

I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于_________腐蚀。(填“化学腐蚀”或“电化学腐蚀”)
(1)红墨水柱两边的液面变为左低右高,则______(填“a”或“b”)边盛有食盐水。
(2)b试管中铁发生的是______腐蚀,(填“析氢腐蚀”或“吸氧腐蚀”)生铁中碳上发生的电极反应式___________。
Ⅱ.下图装罝的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

(1)该装置的能量转化形式为:__________,装置工作时,盐桥中的NH4+移向 __________。(“CuSO4溶液”或“AgNO3溶液”)
(2)若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为_________极,该极反应式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200 mL 0.3 mol·L-1的K2SO4溶液和100 mL 0.2 mol·L-1的 Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO42-的物质的量浓度为 ( )
A. 0.3 mol·L-1 B. 0.4 mol·L-1 C. 0.45 mol·L-1 D. 0.6mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com