
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。

I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于_________腐蚀。(填“化学腐蚀”或“电化学腐蚀”)
(1)红墨水柱两边的液面变为左低右高,则______(填“a”或“b”)边盛有食盐水。
(2)b试管中铁发生的是______腐蚀,(填“析氢腐蚀”或“吸氧腐蚀”)生铁中碳上发生的电极反应式___________。
Ⅱ.下图装罝的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

(1)该装置的能量转化形式为:__________,装置工作时,盐桥中的NH4+移向 __________。(“CuSO4溶液”或“AgNO3溶液”)
(2)若将盐桥换成铜丝,电路中也有电流通过,则铜丝左端为_________极,该极反应式为:__________________________________。
【答案】 电化学 b 吸氧 O2+2H2O+4e-=4OH- 化学能转化为电能 AgNO3溶液 阴 Cu2++2e-=Cu
【解析】试题分析:I.钢铁是合金在水溶液中构成原电池易发生电化学腐蚀,在酸性溶液中发生析氢腐蚀、在中性或碱性溶液中发生吸氧腐蚀;Ⅱ.(1) 该装置是原电池,铜的活泼性大于银,所以铜是负极、银是正极,原电池中阳离子移向正极;(2)若将盐桥换成铜丝,左池中两个电极相同,构成电解池;右池中两个电极不同,构成原电池,铜是负极、银是正极。
解析:根据以上分析,I.钢铁在氯化铵(显酸性)溶液和食盐水中都能构成原电池,都属于电化学腐蚀腐蚀。
(1)红墨水柱两边的液面变为左低右高,说明a中气体增多发生析氢腐蚀、b中气体减少发生吸氧腐蚀,则b盛有食盐水。
(2)b试管中铁发生的是吸氧腐蚀,生铁中碳是正极,正极上氧气得电子发生还原反应,电极反应式是O2+2H2O+4e-=4OH-。
Ⅱ.(1) 该装置是原电池,将化学能转化为电能;铜的活泼性大于银,所以铜是负极、银是正极,原电池中阳离子移向正极,装置工作时,盐桥中的NH4+移向 AgNO3溶液;(2)若将盐桥换成铜丝,左池中两个电极相同,构成电解池;右池中两个电极不同,构成原电池,铜是负极、银是正极。铜丝左端为与原电池的负极相连,所以铜丝左端为电解池的阴极,阴极是铜离子得电子生成铜,阴极反应式为Cu2++2e-=Cu。


科目:高中化学 来源: 题型:
【题目】已知食盐常加入KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:
KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
如果反应中转移0.2mol电子,则生成I2的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为__________________;
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为_____________mol;
(3)如果盐酸过量,生成CO2的体积为______________L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道_______________;
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁一空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。有关该电池的说法不正确的是

A. 通入氧气的电极为正极
B. 放电时,溶液中的OH-由正极移向负极
C. 负极的电极反应为Mg-2e-+2OH-=Mg(OH)2
D. 当电路中转移0.04 mol电子时,参加反应的O2为0.02 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算题(写出计算过程)
在标准状态下,有体积为4.48L的氯化氢,溶于水得到1L溶液(为盐酸)。请计算:
(1)该盐酸中HCl的物质的量是多少?
_________________
(2)Cl-物质的量是多少?溶液H+物质的量浓度是多少?
_________________
(3)若该盐酸密度为ρ g/cm3,则溶质的质量分数为多少?(用含ρ式子表示)
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2 mol氨气,下列说法正确的是
A. 质量为17 g
B. 含有6.02×![]() 个NH3分子
个NH3分子
C. 标准状况下的体积为44.8 L
D. 溶于1 L水后,溶液中NH4+的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是
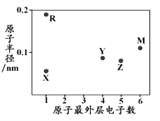
A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性:Y<M
C. 最简单氢化物的稳定性:Y<Z
D. Z的简单氢化物可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数由大到小顺序排列的是 ( )
①0.5 mol氨气 ②4 g氦气 ③4 ℃时9 mL水 ④0.2 molH3PO4
A. ④③②① B. ①④③② C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,己知Co、Fe均为中等活泼金属)的工艺流程如图所示:

问答下列问题:
(l)(NH4)2C2O4中C元素的化合价为________。
(2)合金废料加入盐酸浸取,该盐酸不能换为硝酸,原因是____________。
残渣M的主要成分是一种金属单质,该金属为_______________,
(3)“浸出液”中先后加入的两种试剂涉及氨水、H2O2溶液,应先加入____________,加入氨水发生反应的离+方程式为____________________。
(4)溶液A中的金属阳离子是_________,加入(NH4)2C2O4溶液的目的是__________ 。
(5)“操作1”的名称是_________,草酸钴高温焙烧生成Co2O3,实验室中高温焙烧使用的仪器是_____(填字)。
a.蒸发皿 b.表面皿 c.烧杯 d.坩埚
(6)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。“操作2”中,蒸发浓缩后必须趁热过滤,其目的是_________________,90℃时Ksp(Li2CO3)的值为___________。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com