
【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
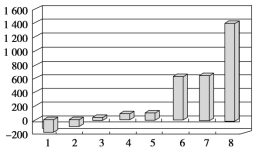
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如图所示,则其中“2”原子的结构示意图为____________,“8”原子的电子排布式为________________。
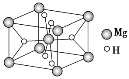
(3)氢化镁储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为__________,晶胞的体积为__________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有_______个σ键,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______________。
),则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
)的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
(6)Si、C和O的成键情况如下:
化学键 | C—O | C===O | Si—O | Si===O |
360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:_______________________________________________________
【答案】sp3 V形或折线形 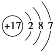 1s22s22p63s23p2或[Ne]3s23p2 MgH2
1s22s22p63s23p2或[Ne]3s23p2 MgH2 ![]() MgO>CaO>KCl 12 9
MgO>CaO>KCl 12 9 ![]() 吡咯分子间可形成氢分键,而噻吩分子间不能形成氢键 碳与氧之间形成含有双键的分子放出的能量(803 kJ·mol-1×2=1 606 kJ·mol-1)大于形成含单键的原子晶体放出的能量(360 kJ·mol-1×4=1 440 kJ·mol-1),故碳与氧之间易形成含双键的CO2分子晶体;硅与氧之间形成含有双键的分子放出的能量(640 kJ·mol-1×2=1 280 kJ·mol-1)小于形成含单键的原子晶体放出的能量(464 kJ·mol-1×4=1 856 kJ·mol-1),故硅与氧之间易形成含单键的SiO2原子晶体
吡咯分子间可形成氢分键,而噻吩分子间不能形成氢键 碳与氧之间形成含有双键的分子放出的能量(803 kJ·mol-1×2=1 606 kJ·mol-1)大于形成含单键的原子晶体放出的能量(360 kJ·mol-1×4=1 440 kJ·mol-1),故碳与氧之间易形成含双键的CO2分子晶体;硅与氧之间形成含有双键的分子放出的能量(640 kJ·mol-1×2=1 280 kJ·mol-1)小于形成含单键的原子晶体放出的能量(464 kJ·mol-1×4=1 856 kJ·mol-1),故硅与氧之间易形成含单键的SiO2原子晶体
【解析】
(1)SCl2中S原子杂化轨道数为![]() (6+2)=4,采取 sp3杂化方式,两对孤对电子对,所以该分子构型为V形或折线形;
(6+2)=4,采取 sp3杂化方式,两对孤对电子对,所以该分子构型为V形或折线形;
(2)第三周期8种元素按单质算,排除氩气外,只有氯气为气体,熔点较低,氯原子核电荷数为17,原子的结构示意图为: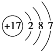 ;“8”为硅原子,原子的电子排布式为1s22s22p63s23p2或[Ne]3s23p2;
;“8”为硅原子,原子的电子排布式为1s22s22p63s23p2或[Ne]3s23p2;
(3)根据晶胞结构可知,该晶胞中含有镁原子个数为8×![]() +1=2, 含有氢原子个数为4×
+1=2, 含有氢原子个数为4×![]() +2=4,镁原子与氢原子个数比为1:2,所以氢化镁化学式为MgH2;该晶胞中含有2个MgH2,则该晶胞的体积为
+2=4,镁原子与氢原子个数比为1:2,所以氢化镁化学式为MgH2;该晶胞中含有2个MgH2,则该晶胞的体积为![]() =
=![]() cm3;
cm3;
(4) 晶格能越大,离子晶体熔点就越高,而晶格能大小与离子的电荷和半径有关,电荷越多,离子半径越小,晶格能就越大;KCl、MgO、CaO这3种晶体的结构与NaCl晶体结构相似,MgO、CaO中离子都带2个单位电荷,KCl中离子都带1个单位电荷,离子半径Cl->O2-,Mg2+<Ca2+<K+,高价化合物的晶格能远大于低价离子化合物的晶格能,晶格能MgO>CaO>KCl ,故熔点MgO>CaO>KCl;在MgO晶胞中Mg2+周围有六个O2-,O2-周围有六个Mg2+,根据晶胞的结构可以看出,如果以体心上一个Mg2+为究对象,和它最邻近且等距离的Mg2+分布在晶胞每个棱边中点上,共有12个;
(4)①单键为σ键,双键中一根为σ键,一根为π键,噻吩为:![]() ,则1个噻吩分子中含σ键有5+4=9个,噻吩分子为平面结构,S原子价电子排布式为3s23p4,形成两根共价键,环中存在两根π键,为单双建交替,pz轨道交盖可形成离域大π键,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,噻吩的芳香性仅比苯弱一点,符合休克尔规则,形成五中心六电子的离域大π键,记为
,则1个噻吩分子中含σ键有5+4=9个,噻吩分子为平面结构,S原子价电子排布式为3s23p4,形成两根共价键,环中存在两根π键,为单双建交替,pz轨道交盖可形成离域大π键,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,噻吩的芳香性仅比苯弱一点,符合休克尔规则,形成五中心六电子的离域大π键,记为![]() ;
;
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键使沸点升高,
)的沸点在129~131℃之间,后者沸点较高,吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键使沸点升高,
故答案为:吡咯分子间可形成氢键,而噻吩分子间不能形成氢键;
(6) C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,其原因: 碳与氧之间形成含有双键的分子放出的能量(2×803 kJmol-1=1606 kJmol-1)大于形成含单键的原子晶体放出的能量(4×360 kJmol-1=1440 kJmol-1),故碳与氧之间易形成含双键的CO2分子晶体;硅与氧之间形成含有双键的分子放出的能量(2×640 kJmol-1=1280 kJmol-1)小于形成含单键的原子晶体放出的能量(4×464 kJmol-1=1856 kJmol-1),故硅与氧之间易形成含单键的SiO2原子晶体;正确答案:碳与氧之间形成含有双键的分子放出的能量(2×803 kJmol-1=1606 kJmol-1)大于形成含单键的原子晶体放出的能量(4×360 kJmol-1=1440 kJmol-1),故碳与氧之间易形成含双键的CO2分子晶体;硅与氧之间形成含有双键的分子放出的能量(2×640 kJmol-1=1280 kJmol-1)小于形成含单键的原子晶体放出的能量(4×464 kJmol-1=1856 kJmol-1),故硅与氧之间易形成含单键的SiO2原子晶体。


科目:高中化学 来源: 题型:
【题目】已知拆开1 mol O2(g)中的化学键需要吸收498 kJ的能量。根据能量变化示意图,下列说法不正确的是
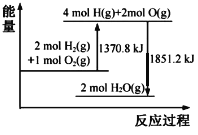
A.2H2(g)+O2(g)=2H2O(l) △H=-480.4 kJ·molˉ1
B.H2O(g)=H2(g)+![]() O2(g) △H=240.2 kJ·molˉ1
O2(g) △H=240.2 kJ·molˉ1
C.拆开1 mol H2(g)中的化学键需要吸收436.4 kJ的能量
D.H2(g)和O2(g)形成H2O(g)中的1 mol H-O键放出462.8 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下某烃与H2按物质的量之比1:2加成生成C2H5CH (CH3)2,则该烃的结构简式为(任写1种)______________________。
(2)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的2种物质的结构简式___________________、_____________________。
(3)有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质。

请回答下列问题:
①在甲~庚七种物质中,互为同分异构体的是_________________(填编号,下同),可看作酯类的是___________________。
②写出由甲生成高分子化合物的方程式:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ①④⑤⑥⑦⑧C. ③④⑤⑥⑦D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氟气混合在黑暗处即可爆炸并放出大量的热。在反应过程中,断裂![]() 中的化学键消耗的能量为
中的化学键消耗的能量为![]() ,断裂
,断裂![]() 中的化学键消耗的能量为
中的化学键消耗的能量为![]() ,形成
,形成![]() 中的化学键释放的能量为
中的化学键释放的能量为![]() ,下列关系式中,一定正确的是( )
,下列关系式中,一定正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常作有机合成的催化剂。实验室用熔融的锡(熔点为231.9 ℃)与氯气反应制备SnCl4。装置如图所示(加热装置省略)。
已知:①SnCl4、SnCl2有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4在空气中极易水解生成SnO2·xH2O。
③在常温下,用KClO3和浓盐酸反应制备氯气。
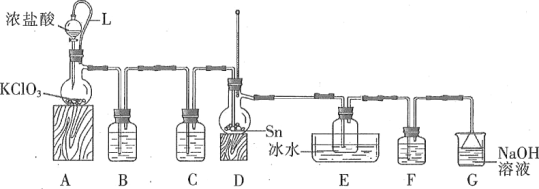
(1)写出装置A中发生反应的化学方程式:_____。
(2)下列说法不正确的是____。(填字母)
A.F和C中试剂相同,E中的冰水冷却产品
B.导管L平衡气压,使浓盐酸顺利下滴
C.先通入氯气,当D充满黄绿色气体时加热烧瓶
D.除去产品中氯气的方法是加入SnCl2溶液
(3)用化学方程式表示拆去F装置对实验的影响:_____。
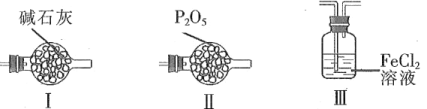
(4)F和G装置可以用下列装置代替的是____。(填代号)
(5)加热D使锡熔融后需要继续加热,其一为了加快锡与氯气反应,其二为了____。
(6)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液VmL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分,扇面的18折相当于中学化学常见长式元素周期表的18列,1、2、3、4相当于周期,针对表中所给元素,对照中学化学常见长式元素周期表,回答下列问题:
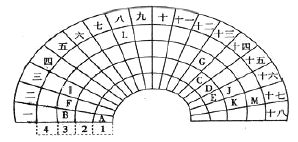
(1)表中金属性最强的元素在长式元素周期表中的位置是___________,该元素单质与水反应的化学方程式为______________。
(2)表中最高价氧化物对应的水化物酸性最强的是__________(填酸的化学式)。
(3)元素F与K形成化合物的电子式为__________。
(4)写出元素D最高价氧化物对应水化物的稀溶液与铜单质反应的离子方程式_________。
(5)元素G的最高价氧化物对应水化物跟氢氧化钠溶液反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为____。
(2)上述反应中的氧化剂是____,反应产生的气体可用_____吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,若生成2mol H3AsO4,则反应中转移电子的数目为____。
(4)若反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量___(填字母)。
A.小于0.5mol B.等于0.5mol C.大于0.5mol D.无法确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com