
【题目】氢气和氟气混合在黑暗处即可爆炸并放出大量的热。在反应过程中,断裂![]() 中的化学键消耗的能量为
中的化学键消耗的能量为![]() ,断裂
,断裂![]() 中的化学键消耗的能量为
中的化学键消耗的能量为![]() ,形成
,形成![]() 中的化学键释放的能量为
中的化学键释放的能量为![]() ,下列关系式中,一定正确的是( )
,下列关系式中,一定正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】化学与人类的生活、生产息息相关,下列说法正确的是
A.氯水和食盐水消毒杀菌的原理相同
B.制造普通玻璃的原料为石英砂、石灰石和纯碱
C.为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D.可以用钢瓶储存液氯和浓H2SO4,因为它们对钢瓶发生了钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,相同物质的量浓度的下列溶液中:①NaCl②NaOH③H2SO4④(NH4)2SO4,其中水的电离程度由大到小顺序___(填序号)。
(2)25℃时,体积相同,浓度均为0.2mol·L-1的氨水和NaOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为___;常温下,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为___;
(3)用离子方程式解释碳酸钠溶液呈碱性的原因:___。
(4)能证明CH3COOH是弱酸的事实是___。
A.CH3COOH易挥发
B.常温下,0.1mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
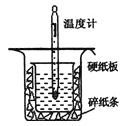
(1)从图中实验装置看,其中尚缺少的一种玻璃用品是___;
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___。
(3)若改用60mL0.25mol·L-1H2SO4和50mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量___(填“相等”、“不相等”),若实验操作均正确,则所求中和热___(填“相等”、“不相等”)
(4)50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的实验数据如下表:
请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ①___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=___J/mol(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、b均能与稀硫酸反应放出气体;②c与d的硝酸盐溶液反应,置换出单质d;③b与强碱反应放出气体;④b、e在冷的浓硫酸中钝化。由此可判断a、b、c、d、e依次是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第三周期包括Na、Mg、Al、Si、P、S、Cl、Ar 8种元素。请回答下列问题:
(1)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(2)第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“1”代表Ar)如图所示,则其中“2”原子的结构示意图为____________,“8”原子的电子排布式为________________。
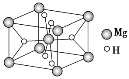
(3)氢化镁储氢材料的晶胞结构如图所示,已知该晶体的密度为ρ g·cm-3,则该晶体的化学式为__________,晶胞的体积为__________cm3(用ρ、NA表示,其中NA表示阿伏加德罗常数的值)。
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是________________。其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有________个。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有_______个σ键,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______________。
),则噻吩分子中的大π键应表示为______________。
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
)的沸点在129~131℃之间,后者沸点较高,其原因是__________________________________。
(6)Si、C和O的成键情况如下:
化学键 | C—O | C===O | Si—O | Si===O |
360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因:_______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应时,Na、NaOH、NaHCO3的物质的量之比为( )

A. 3∶3∶2B. 3∶2∶1
C. 1∶1∶1D. 3∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是天然气的主要成分,以A为原料可以得到B、C、D、E、F其转化关系如下图所示,已知烃B是相同状态下氢气密度的13倍,C是有刺激性气味的液体,F具有芳香气味,B、C、D、E具有相同的碳原子数。
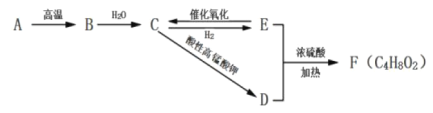
(1)B的分子式为____________。
(2)有机物E中含氧官能团的名称是____________。
(3)![]() 属于羧酸的同分异构体有____________种。
属于羧酸的同分异构体有____________种。
(4)下列说法正确的是___________。
A.有机物E与钠反应比水与钠反应要剧烈
B.有机物D、E、F可以用饱和碳酸钠溶液鉴别
C.有机物B、C、E均能使酸性高锰酸钾溶液退色
D.实验室制备F时,浓硫酸主要是吸水剂和催化剂
(5)写出E生成C的化学方程式___________。
(6)写出D和E生成F的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①Ca(ClO)2的名称为____________;
②磁铁矿主要成分的化学式为____________。
(2)请按要求完成相应的方程式:
①金属镁在二氧化碳中燃烧的化学方程式____________。
②铜与浓硫酸混合加热的化学方程式____________。
③用离子方程式说明用磨合玻璃塞的试剂瓶不可装NaOH溶液的原因:____________。
④用FeCl3溶液与铜反应制作印刷电路板的离子方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com