
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
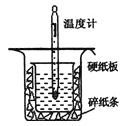
(1)从图中实验装置看,其中尚缺少的一种玻璃用品是___;
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___。
(3)若改用60mL0.25mol·L-1H2SO4和50mL0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量___(填“相等”、“不相等”),若实验操作均正确,则所求中和热___(填“相等”、“不相等”)
(4)50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的实验数据如下表:
请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ①___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=___J/mol(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】环形玻璃搅拌棒 隔热,减少热量的损失 不相等 相等 3.4 -56.8 acd
【解析】
(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是减少热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)①先计算出每次实验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②先根据Q=mc△t计算反应放出的热量,然后根据△H=-![]() kJ/mol计算出中和热;
kJ/mol计算出中和热;
③根据实验操作分析作答。
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:隔热,减少热量的损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.25mol/LH2SO4和50mL0.55mol/LNaOH溶液进行反应与上述实验相比,生成水的量增多,所放出的热量增多;但是中和热均是强酸和强碱反应生成1mol水时放出的热,中和热相等,故答案为:不相等;相等;
(4)①四次测定温度差分别为3.4℃,5.1℃,3.3℃,3.5℃,其中第2次的温度差误差较大,应该舍弃,其它三次温度差的平均值为t=![]() ℃=3.4℃,故答案为:3.4;
℃=3.4℃,故答案为:3.4;
②50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△t=3.4℃,则生成0.025mol水放出的热量为:Q=mc△t=100g×4.18J/(g℃)×3.4℃=1421.2J=1.4212kJ,所以实验测得的中和热△H=-![]() =-56.8 kJ/mol,故答案为:-56.8;
=-56.8 kJ/mol,故答案为:-56.8;
③计算的数据为-56.8kJ/mol与-57.3kJ/mol有偏差,应为在做实验中有热量损失,
a. 实验装置保温、隔热效果差,有热量损失,a项符合题意;
b.量取NaOH溶液的体积时仰视读数,NaOH溶液体积偏大,放出热量偏大,b项不符合题意;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,c项符合题意;
d. 温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,由于温度计上会有氢氧化钠,氢氧化钠与硫酸反应放热,导致硫酸的起始温度偏高,温度差偏小,测定结果偏小,d项符合题意;
综上符合题意选项是acd,故答案为:acd。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol·L-1的一元酸HA与等浓度NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )

A. HA为强酸
B. 该混合溶液pH=7.0
C. 该混合溶液中:c(A-)+c(Y)=c(Na+)
D. 图中X表示HA,Y表示OH-,Z表示H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下某烃与H2按物质的量之比1:2加成生成C2H5CH (CH3)2,则该烃的结构简式为(任写1种)______________________。
(2)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的2种物质的结构简式___________________、_____________________。
(3)有机物甲的结构简式如下,它可通过不同的化学反应分别制得结构简式为乙~庚的物质。

请回答下列问题:
①在甲~庚七种物质中,互为同分异构体的是_________________(填编号,下同),可看作酯类的是___________________。
②写出由甲生成高分子化合物的方程式:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
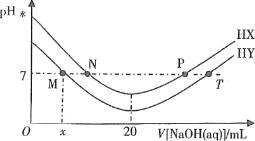
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ①④⑤⑥⑦⑧C. ③④⑤⑥⑦D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氟气混合在黑暗处即可爆炸并放出大量的热。在反应过程中,断裂![]() 中的化学键消耗的能量为
中的化学键消耗的能量为![]() ,断裂
,断裂![]() 中的化学键消耗的能量为
中的化学键消耗的能量为![]() ,形成
,形成![]() 中的化学键释放的能量为
中的化学键释放的能量为![]() ,下列关系式中,一定正确的是( )
,下列关系式中,一定正确的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分,扇面的18折相当于中学化学常见长式元素周期表的18列,1、2、3、4相当于周期,针对表中所给元素,对照中学化学常见长式元素周期表,回答下列问题:
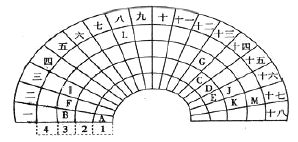
(1)表中金属性最强的元素在长式元素周期表中的位置是___________,该元素单质与水反应的化学方程式为______________。
(2)表中最高价氧化物对应的水化物酸性最强的是__________(填酸的化学式)。
(3)元素F与K形成化合物的电子式为__________。
(4)写出元素D最高价氧化物对应水化物的稀溶液与铜单质反应的离子方程式_________。
(5)元素G的最高价氧化物对应水化物跟氢氧化钠溶液反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种常见物质中均含有同一种元素,它们之间有如图所示的转化关系(部分反应物质已略去)。下列说法不正确的是
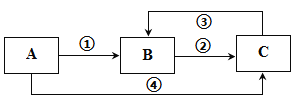
A. 若A是一种两性氧化物,则B的水溶液可呈酸性,C的水溶液可呈碱性
B. 若A为一种金属单质时,则反应①、②、③均可为化合反应,反应④可为置换反应
C. 若A、B、C是三种不同类别的固态物质,则B可以是工业上制取A、C的原料
D. 若A、B均是可燃性物质,完全燃烧都生成气体C,常温下A溶液pH<7,则将C通入A溶液中,pH值先减小后增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com