
【题目】氮化硅(Si3N4)可用作高级耐火材料、新型陶瓷材料、LED基质材料等。已知:Si的电负性比H的小,利用硅烷(SiH4)制备氮化硅的反应为 。下列有关说法正确的是( )
。下列有关说法正确的是( )
A.硅烷中Si的化合价为-4价B.NH3在该反应中作还原剂
C.H2既是氧化产物,也是还原产物D.转移1.2mol电子时,生成26.88 L H2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了研究一定量碳酸钙与足量稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。
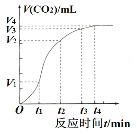
下列说法不正确的是
A.由图像可知,该反应是放热反应
B.0—t1时间段,CO2的化学反应速率v=![]() (mL·min-1)
(mL·min-1)
C.根据(V3—V2)<(V2—V1),推测反应速率减慢的原因可能是盐酸浓度减小
D.由图像可知,0—t1的反应速率比t1—t2的反应速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是
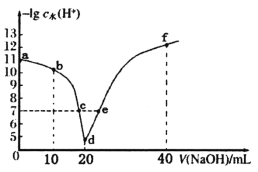
A.从a到d,HA的电离先促进再抑制
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质结构的命题中,错误的项数有( )
①CH3COOH分子中碳原子的杂化类型有sp2和sp3两种
②元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于p区
③非极性分子往往具有高度对称性,如BF3、PCl5、H2O2、CO2这样的分子
④Na2O、Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 :2
⑤Cu(OH)2是一种蓝色絮状沉淀,既能溶于硝酸、也能溶于氨水,是两性氢氧化物
⑥氨水中大部分NH3与H2O以氢键(用“...”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式可记为: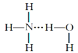
⑦HF沸点高于HCl,是因为 HCl共价键键能小于HF
⑧可燃冰中甲烷分子与水分子之间存在氢键
A.4项B.5项C.6项D.7项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
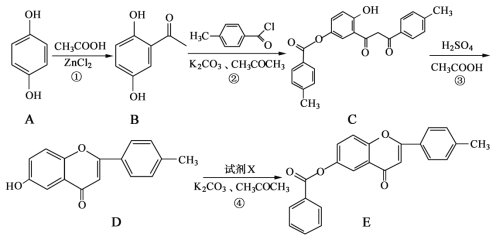
请回答下列问题:
(1)化合物B中的含氧官能团为__________和_____________(填名称)。
(2)反应③中涉及到的反应类型有水解反应、_____________和_____________。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为________________。
(4)B的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___________________
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
(5)已知: 。根据已有知识并结合相关信息,写出以
。根据已有知识并结合相关信息,写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备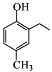 的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:
的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
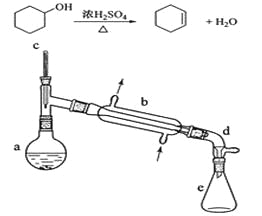
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
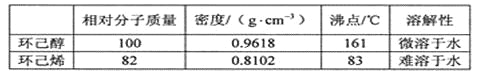
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是__________________。
(2)加入碎瓷片的作用是_______________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时_____________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________。
(4)分液漏斗在使用前须清洗干净并____________;在本实验分离过程中,产物应该从分液漏斗的_________________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有___________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是____________(填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为 ![]() +CH3OH
+CH3OH![]()
![]() +H2O
+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是_______;分离出有机相的操作名称为__________。
(3)步骤4中,蒸馏时不能用水浴加热的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.46g乙醇中存在的共价键总数为7NA
B.HNO3作为氧化剂得到的电子数一定为3NA
C.1mol甲醇完全燃烧时,转移的电子数为6NA
D.将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2![]() =Mg2++2NH3H2O
=Mg2++2NH3H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:![]() +2CH3COOH=2CH3COO+H2O+CO2↑
+2CH3COOH=2CH3COO+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com