
【题目】根据下列图示所得出的结论正确的是( )
A. 图甲所示某可逆反应达到化学平衡后,在t1时刻改变的条件可能是加入催化剂
图甲所示某可逆反应达到化学平衡后,在t1时刻改变的条件可能是加入催化剂
B.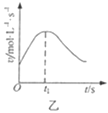 图乙表示除去氧化膜的镁条与盐酸反应生成氢气的速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
图乙表示除去氧化膜的镁条与盐酸反应生成氢气的速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
C.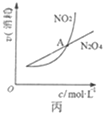 图丙表示恒温恒容条件下,2NO2(g)
图丙表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D.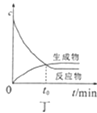 图丁表示某可逆反应物质的浓度随反应时间的变化,在t0时刻反应物的转化率最大
图丁表示某可逆反应物质的浓度随反应时间的变化,在t0时刻反应物的转化率最大
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】下列对有关微粒的相互关系和特征描述正确的是( )
选项 | 微粒 | 相互关系 | 特征描述 |
A | C60、C70、C540 | 同位素 | 微粒中只含非极性共价键 |
B | 新烷、2,2﹣二甲基丙烷 | 同分异构体 | 常温常压下呈气态 |
C |
| 同素异形体 | 铂作氨催化氧化时的催化剂 |
D | 甲酸、硬脂酸 | 同系物 | 能发生酯化反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证次氯酸光照分解的产物,某同学采用三种传感器分别测得氯水光照过程中pH、Cl-浓度、![]() 体积分数的变化,实验数据如图所示,下列叙述错误的是( )
体积分数的变化,实验数据如图所示,下列叙述错误的是( )
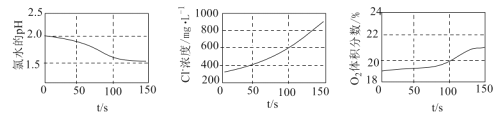
A.从0 s到150 s,溶液pH降低的原因是![]() 的电离程度增大
的电离程度增大
B.从0 s到150 s,溶液中![]() 增加到起始浓度的
增加到起始浓度的![]() 倍
倍
C.从50 s到150 s,![]() 的平均生成速率约为
的平均生成速率约为![]()
D.![]() 光照分解的产物有
光照分解的产物有![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示物质间的转化均能实现的是( )
A.CH3CH2CH2Br![]() CH3CH=CH2
CH3CH=CH2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
B.NaOH(aq)![]() C6H5ONa(aq)
C6H5ONa(aq)![]() NaHCO3(aq)
NaHCO3(aq)
C.NaOH(aq)![]() Cu(OH)2浑浊液
Cu(OH)2浑浊液![]() Cu2O(s)
Cu2O(s)
D.石油![]() CH3CH=CH2
CH3CH=CH2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可腐蚀印刷电路板上的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH
已知①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH1=64kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-286kJ·mol-1
O2(g)=H2O(l) ΔH3=-286kJ·mol-1
下列说法不正确的是( )
A.反应①可通过铜作电极电解稀的H2SO4方法实现
B.反应②在任何条件下都能自发进行
C.若H2(g)+![]() O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3
O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3
D.ΔH=-320kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示。已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
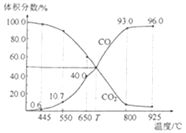
A.550℃时,若充入稀有气体,v正、v逆均减小,平衡不移动
B.T℃时,反应达平衡后CO2的转化率为50%
C.T℃时,若充入等体积的CO2和CO,平衡不移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期目的是( )
实验操作 | 实验目的 | |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 苯酚和水的浊液中,加少量浓碳酸钠溶液 | 比较苯酚与碳酸氢钠的酸性 |
D | 取少量溶液滴加Ca(OH)2溶液,观察是否出现白色浑浊 | 确定NaHCO3溶液中是否混有Na2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.同一原子中,![]() 、
、![]() 、
、![]() 电子的能量逐渐减小
电子的能量逐渐减小
B.同一原子中,![]() 上的电子较
上的电子较![]() 上的电子离核远
上的电子离核远
C.能量高的电子在离核近的区域运动,能量低的电子在离线远的区域运动
D.各能层含有的能级数为![]() (
(![]() 为能层序数)
为能层序数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭吸附法是工业 提碘的主要方法之一,其流程如下:
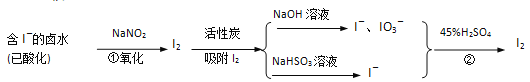
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的方向和数目___________________________________________________。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I-选择了价格并不便宜的亚硝酸钠,可能的原因是____________________________________。
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是_______________________________________。
(4)流程中,碘元素经过了I-→I2→I-、IO3-→I2的变化过程,这样反复操作的目的是___________。
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在两种程度不同的平衡体系:水解_______________________________和电离_______________________________(用离子方程式表示)
(6)如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
①加入少量Ba(OH)2固体,水解平衡向_________移动。
②加入少量NaClO固体,溶液的pH_________(选填:增大、减小、不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com