
����Ŀ������̿�������ǹ�ҵ ������Ҫ����֮һ�����������£�
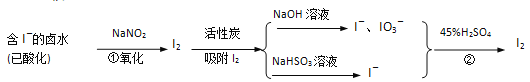
���������գ�
(1)���������£�NaNO2��Һֻ�ܽ�I������ΪI2��ͬʱ����NO��д����Ӧ�ٵ����ӷ���ʽ���������ת�Ƶķ������Ŀ___________________________________________________��
(2)������Ũ���ᡢ���Ը�����صȶ��dz��õ�ǿ������������ҵ������±ˮ�е�I��ѡ���˼۸����˵��������ƣ����ܵ�ԭ����____________________________________��
(3)��Ӧ�ڷ���ʱ����Һ�ײ����Ϻ�ɫ�������ɣ���ʱ��Һ�Ϸ�������ɫ���壬�������������ԭ����_______________________________________��
(4)�����У���Ԫ�ؾ�����I����I2��I����IO3����I2�ı仯���̣���������������Ŀ����___________��
(5)���������õ�NaHSO3��Һ�������ԣ�Դ��NaHSO3�������̶ֳȲ�ͬ��ƽ����ϵ��ˮ��_______________________________�͵���_______________________________�������ӷ���ʽ��ʾ��
(6)����0.1mol/L��NaHSO3��Һ�зֱ�����������ʣ��ش����⣺
�ټ�������Ba(OH)2���壬ˮ��ƽ����_________�ƶ���
�ڼ�������NaClO���壬��Һ��pH_________��ѡ�����С�����䣩��
���𰸡�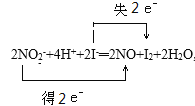 ������Ũ���ᡢ���Ը������������̫ǿ�����ܼ�������I2 ����ˮ���ܽ�Ȳ����������� ������Ԫ�� HSO3�C + H2OH2SO3 + OH�C HSO3�CH++SO32- �淴Ӧ���� ��С
������Ũ���ᡢ���Ը������������̫ǿ�����ܼ�������I2 ����ˮ���ܽ�Ȳ����������� ������Ԫ�� HSO3�C + H2OH2SO3 + OH�C HSO3�CH++SO32- �淴Ӧ���� ��С
��������
(1)�������ƾ��������ԣ������Ӿ��л�ԭ�ԣ����������£����߷���������ԭ��Ӧ����һ�������͵��ˮ��
(2)������Ũ���ᡢ���Ը�����ص�������̫ǿ�����ܼ��������ⵥ�ʣ�
(3)����ˮ�е��ܽ�Ȳ�������������
(4)�����У���Ԫ�ؾ�����I2��I-��IO3-��I2�ı仯���̣�����������ԭ���Ǹ�����Ԫ�أ�
(5)NaHSO3��Һ�������ԣ�����ΪHSO3-�ĵ���̶ȴ���ˮ��̶ȣ�
(6) ����Ba(OH)2��OH-Ũ������ƽ�������ƶ�����������NaClO���壬����������ԭ��Ӧ����������Ȼ��ƣ���ҺpH��С��
(1)�������ƾ��������ԣ������Ӿ��л�ԭ�ԣ����������£����߷���������ԭ��Ӧ����һ�������͵��ˮ�����ӷ�Ӧ����ʽΪ��2NO2-+4H++2I-�T2NO+I2+2H2O, ����ת�Ƶķ������Ŀ����Ϊ: ��
��
(2)������Ũ���ᡢ���Ը�����ص�������̫ǿ�����ܼ��������ⵥ�ʣ��ʹ�ҵ������±ˮ��I-ѡ���˼۸����˵��������ƣ�
(3)��Ӧ�ڷ���ʱ����Һ�ײ����Ϻ�ɫ�Ĺ������ɣ���ʱ��Һ�Ϸ�������ɫ�����壬���Ͳ������������ԭ�� ����ˮ�е��ܽ�Ȳ�������������
(4)�����У���Ԫ�ؾ�����I2��I-��IO3-��I2�ı仯���̣�����������ԭ���� ������Ԫ�أ�
(5) NaHSO3��Һ�������ԣ�����Ϊ����Һ�д������µ�ƽ�⣺��ˮ��ƽ�⣺HSO3-+H2OH2SO3+OH-�͢ڵ���ƽ�⣺HSO3-SO32-+H+������̶ȴ���ˮ��̶ȣ�
(6)�ټ���Ba(OH)2��OHŨ������ƽ�������ƶ���
�ڼ�������NaClO���壬����������ԭ��Ӧ����������Ȼ��ƣ���ҺpH��С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ�����ȷ���ǣ� ��
A. ͼ����ʾij���淴Ӧ�ﵽ��ѧƽ�����t1ʱ�̸ı�����������Ǽ������
ͼ����ʾij���淴Ӧ�ﵽ��ѧƽ�����t1ʱ�̸ı�����������Ǽ������
B.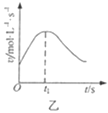 ͼ�ұ�ʾ��ȥ����Ĥ��þ�������ᷴӦ���������������淴Ӧʱ��仯�����ߣ�˵��t1ʱ����Һ���¶����
ͼ�ұ�ʾ��ȥ����Ĥ��þ�������ᷴӦ���������������淴Ӧʱ��仯�����ߣ�˵��t1ʱ����Һ���¶����
C.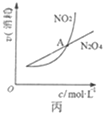 ͼ����ʾ���º��������£�2NO2(g)
ͼ����ʾ���º��������£�2NO2(g)![]() N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
D.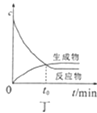 ͼ����ʾij���淴Ӧ���ʵ�Ũ���淴Ӧʱ��ı仯����t0ʱ�̷�Ӧ���ת�������
ͼ����ʾij���淴Ӧ���ʵ�Ũ���淴Ӧʱ��ı仯����t0ʱ�̷�Ӧ���ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����(����)
A. ��ϩ���Ȼ���ӳɵIJ�����2�� B. ������![]() �Ķ���ȡ������15��
�Ķ���ȡ������15��
C. ������![]() ������ȡ������3�� D. ����ʽΪCCl2F2������ֻ��һ�ֿռ�ṹ
������ȡ������3�� D. ����ʽΪCCl2F2������ֻ��һ�ֿռ�ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����0.10molL��1�İ�ˮ�������ж���ȷ����
A.��AlCl3��Һ��Ӧ���������ӷ���ʽΪ Al3++3OH���TAl��OH��3��
B.��HNO3��Һ��ȫ�кͺ���Һ��������
C.��ˮϡ�ͺ���Һ��c��NH4+��c��OH�������
D.1L0.1molL��1�İ�ˮ����6.02��1022��NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���輰�仯����㷺Ӧ����̫���ܵ����á����ά�������Ʊ��ȣ�
�����Ĺ��Ǵ���Ȼ���е�ʯӢ��ʯ����Ҫ�ɷ�ΪSiO2������ȡ����������ȡ���������·�Ӧ������������
��SiO2��s��+2C��s��Si��s��+2CO��g��
��Si��s��+2Cl2��g��SiCl4��g��
��SiCl4��g��+2H2��g����Si��s��+4HCl��g��
���������գ�
��1����ԭ�Ӻ�����______ �ֲ�ͬ�ܼ��ĵ��ӣ������p������______����������SiO2������ÿ����ԭ����______����ԭ��ֱ��������
��2�����ʵĻ�ԭ�ԣ�̼______�裨��д��ͬ��������ǿ��������������������ƽ����ӽǶ��ԣ���Ӧ���ܽ��е�ԭ����______��
��3����Ӧ�����ɵĻ�������ӿռ乹��Ϊ���÷���Ϊ______���ӣ���д�������������Ǽ���������
��4��ij�¶��£���Ӧ�����ݻ�ΪV�����ܱ������н��У��ﵽƽ��ʱCl2��Ũ��Ϊa mol/L��Ȼ��Ѹ����С�����ݻ���0.5V����t������´ﵽƽ�⣬Cl2��Ũ��Ϊb mol/L����a______b����д����������������������С��������
��5����t���ڣ���Ӧ���з�Ӧ����v��SiCl4��=______���ú�a��b�Ĵ���ʽ��ʾ����
��6����ҵ�ϻ�����ͨ�����·�Ӧ��ȡ���裨����������
��Si���֣�+3HCl��g��![]() SiHCl3��l��+H2��g��+Q��Q��0��
SiHCl3��l��+H2��g��+Q��Q��0��
��SiHCl3��g��+H2��g��![]() Si������+3HCl��g��
Si������+3HCl��g��
��߷�Ӧ����Si�������IJ��ʣ��ɲ�ȡ�Ĵ�ʩ�У�______��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����������̼��������ȴ�����Ⱦ��Ĵ���������Ҫ���塣
I.��֪����N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ��mol-1
��CO��ȼ���ȡ�H=-283 kJ��mol-1��
(1)�����������ڰ�װ�Ĵ�ת��������ʹβ������Ҫ��Ⱦ��(NO��CO)ת��Ϊ���Ĵ���ѭ�����ʣ��÷�Ӧ���Ȼ�ѧ����ʽΪ________________________________��
(2)һ���¶��£��ں����ܱ������г���1 mol NO��2 mol CO���и÷�Ӧ�����в����жϷ�Ӧ�ﵽ��ѧƽ��״̬����___________(��������)
�ٵ�λʱ��������a mol CO��ͬʱ����2a mol NO
�ڻ�������ƽ����Է����������ٸı�
�ۻ��������NO��CO�����ʵ���֮�ȱ��ֲ���
�ܻ��������ܶȲ��ٸı�
II.��������������������Լ�����������ӦΪ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ��(t)�仯������±���
N2O5(g)+O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ��(t)�仯������±���
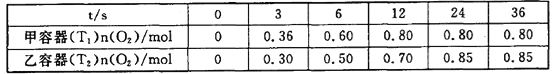
(3)T1______T2(��>��<��=����ͬ)���÷�Ӧ��H________0��
(4)�������У�0��3s�ڵ�ƽ����Ӧ����v(NO2)=________��
(5)��������NO2ƽ��ת����Ϊ__________��T1ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.18gD2O��18gH2O�к��е���������Ϊ10NA
B.2L0.5mol/L��������Һ�к��е�H+��Ϊ2NA
C.100mL18.4mol/L��Ũ����������ͭ��Ӧ������SO2�ķ���Ϊ0.92mol
D.���³�ѹ�£�7.0g��ϩ���ϩ�Ļ�����к�����ԭ�ӵ���Ŀ��NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������a mol/L NaX��b mol/L NaY��������Һ������˵����ȷ����
A.��a=b��c(X-)=c(Y-)+c(HY)����HXΪǿ��
B.��a=b��pH(NaX)>pH(NaY)����c(X-)+c(OH-)>c(Y-)+c(OH-)
C.��a>b��c(X-)=c(Y-)��������HX>HY
D.������Һ�������ϣ���c(Na+)=(a+b)mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ��������Һ100mL���������ۣ�����������������ۼ������ı仯��ͼ��ʾ������˵��������ǣ� ��

A��H2SO4Ũ��Ϊ4mol/L
B����Һ����������ΪFeSO4
C��ԭ�������NO3��Ũ��Ϊ0.2mol/L
D��AB�η�ӦΪ��Fe+2Fe3+��3Fe2+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com