
【题目】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)Si(s)+2CO(g)
②Si(s)+2Cl2(g)SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______种自旋方向;SiO2晶体中每个硅原子与______个氧原子直接相连.
(2)单质的还原性:碳______硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______.
(3)反应②生成的化合物分子空间构型为;该分子为______分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______(用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g)![]() Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______、______.
【答案】5 1 4 弱于 因为生成物CO为气态,降低CO的浓度,可使平衡正向移动 非极性 小于 ![]() mol/(Ls) 降低压强 升高温度(或及时分离出HCl等) .
mol/(Ls) 降低压强 升高温度(或及时分离出HCl等) .
【解析】
(1)硅原子电子排布式:1s22s22p63s23p2,核外有5种不同能级的电子,当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先占据不同轨道,而且自旋方向相同,最外层的p电子有1种自旋方向;SiO2晶体中每个硅原子与4个氧原子形成4个SiO共价键;故答案为:5;1;4;
(2)非金属性越强单质的氧化性越强,碳的还原性弱于硅;减少生成物CO的浓度,平衡正向移动;故答案为:弱于;因为生成物CO为气态,降低CO的浓度,可使平衡正向移动;
(3)四氯化硅是正四面体结构,SiCl4分子结构对称结构,属于非极性分子;故答案为:正四面体型;非极性;
(4)体积减小,压强增大,平衡正向移动,氯气的物质的量减小,但体积减小更大,浓度增大;故答案为:小于;
(5)氯气的反应速率![]() ,
,![]() ;
;
(6)该反应正向为气体体积增大的反应,降低压强可使平衡正向移动;该反应为吸热反应,升高温度可使反应正向移动;及时分离出HCl,使生成物浓度降低,可使平衡正向移动,故答案为:降低压强;升高温度(或及时分离出HCl等)。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可腐蚀印刷电路板上的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH
已知①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH1=64kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-286kJ·mol-1
O2(g)=H2O(l) ΔH3=-286kJ·mol-1
下列说法不正确的是( )
A.反应①可通过铜作电极电解稀的H2SO4方法实现
B.反应②在任何条件下都能自发进行
C.若H2(g)+![]() O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3
O2(g)=H2O(g) ΔH4,则ΔH4<ΔH3
D.ΔH=-320kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种气态单质![]() 和
和![]() ,已知
,已知![]() 和
和![]() 所含的原子个数相等,分子数之比为
所含的原子个数相等,分子数之比为![]() 。
。![]() 和
和![]() 的原子核内质子数都等于中子数,
的原子核内质子数都等于中子数,![]() 原子
原子![]() 层电子数是
层电子数是![]() 层的3倍。
层的3倍。
(1)![]() 、
、![]() 的元素符号分别为_______。
的元素符号分别为_______。
(2)![]() 中的
中的![]() 值为_______。
值为_______。
(3)![]() 的能层数目为_______。
的能层数目为_______。
(4)![]() 、
、![]() 形成的一种气态化合物与水反应能生成由
形成的一种气态化合物与水反应能生成由![]() 、
、![]() 形成的另一种气态化合物,写出该反应的化学方程式:_______。
形成的另一种气态化合物,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①CH3Cl;②CCl4;③C6H5-NO2;④C6H5-Br;⑤CH3OH;⑥HCHO;⑦CH3COOH;⑧HCOOCH3
完成下列填空:
(1)请用各物质的序号填写空白:
①在常温、常压下是气体的是____________;
②能溶于水的是____________;
③能与钠反应放出H2的____________;
④能与新制Cu(OH)2反应的是____________;
⑤能发生银镜反应的是____________。
(2)互为同分异构体的是____________;(填编号)。
(3)35%~40%的⑥水溶液叫做____________。
(4)工业酒精的有毒成分为____________(填编号)。
(5)写出化学方程式⑤→⑥_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A.NaHS水解反应:HS-+H2O![]() H3O++S2-
H3O++S2-
B.Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O
C.Na2CO3水溶液中存在平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
D.BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭吸附法是工业 提碘的主要方法之一,其流程如下:
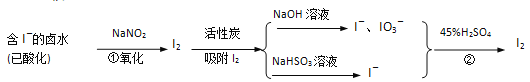
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的方向和数目___________________________________________________。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I-选择了价格并不便宜的亚硝酸钠,可能的原因是____________________________________。
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是_______________________________________。
(4)流程中,碘元素经过了I-→I2→I-、IO3-→I2的变化过程,这样反复操作的目的是___________。
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在两种程度不同的平衡体系:水解_______________________________和电离_______________________________(用离子方程式表示)
(6)如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
①加入少量Ba(OH)2固体,水解平衡向_________移动。
②加入少量NaClO固体,溶液的pH_________(选填:增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图,回答下列问题:
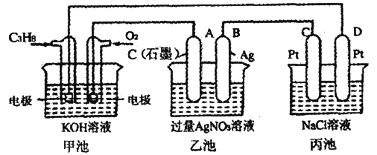
(1)甲池是___________装置,电极B的名称是___________。
(2)甲装置中通入C3H8的电极反应____________,丙装置中D极的产物是___________(写化学式)。
(3)一段时间,当乙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=__________。(已知:NaCl溶液足量,电解后溶液体积为200 mL)。
(4)若要使乙池恢复电解前的状态,应向乙池中加入__________(写物质化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
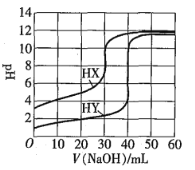
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是短周期元素,
是短周期元素,![]() 元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;
元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;![]() 元素原子最外电子层上
元素原子最外电子层上![]() 、
、![]() 电子数相等;
电子数相等;![]() 元素的
元素的![]() 价阳离子的核外电子排布与氖原子相同;
价阳离子的核外电子排布与氖原子相同;![]() 元素原子的
元素原子的![]() 层有1个未成对的
层有1个未成对的![]() 电子。下列有关这些元素性质的说法一定正确的是( )
电子。下列有关这些元素性质的说法一定正确的是( )
A.![]() 元素的简单氢化物的水溶液显碱性
元素的简单氢化物的水溶液显碱性
B.![]() 元素的离子半径大于
元素的离子半径大于![]() 元素的离子半径
元素的离子半径
C.![]() 元素的单质在一定条件下能与
元素的单质在一定条件下能与![]() 元素的单质反应
元素的单质反应
D.![]() 元素的最高价氧化物在常温下不是气态
元素的最高价氧化物在常温下不是气态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com