
【题目】有两种气态单质![]() 和
和![]() ,已知
,已知![]() 和
和![]() 所含的原子个数相等,分子数之比为
所含的原子个数相等,分子数之比为![]() 。
。![]() 和
和![]() 的原子核内质子数都等于中子数,
的原子核内质子数都等于中子数,![]() 原子
原子![]() 层电子数是
层电子数是![]() 层的3倍。
层的3倍。
(1)![]() 、
、![]() 的元素符号分别为_______。
的元素符号分别为_______。
(2)![]() 中的
中的![]() 值为_______。
值为_______。
(3)![]() 的能层数目为_______。
的能层数目为_______。
(4)![]() 、
、![]() 形成的一种气态化合物与水反应能生成由
形成的一种气态化合物与水反应能生成由![]() 、
、![]() 形成的另一种气态化合物,写出该反应的化学方程式:_______。
形成的另一种气态化合物,写出该反应的化学方程式:_______。
【答案】O、N 3 2 ![]()
【解析】
A原子的L层电子数是K层的3倍,可推知A是氧元素,计算A原子的物质的量,根据含有原子数目相等,可以得到B原子物质的量,进而计算B元素的摩尔质量,确定B元素;再利用原子数目相等确定m、n的值,据此解答。
(1)A原子的L层电子数是K层的3倍,可推知A是氧元素,Am中含A原子的物质的量为![]() =0.15 mol,则Bn中含B原子数也为0.15 mol,B元素原子的摩尔质量=
=0.15 mol,则Bn中含B原子数也为0.15 mol,B元素原子的摩尔质量=![]() =14 g/mol,故B为氮元素;
=14 g/mol,故B为氮元素;
(2)由于n(Am):n(Bn)=2:3,含有原子数目相等,则2m=3n,故m=3,n=2,则Am为O3,Bn为N2;
(3)B原子的能层有K、L,能层数为2个;
(4)由A和B形成的一种气态化合物与水反应能生成由A、B形成的另一种气态化合物,得相关化学反应为NO2溶于水生成NO,化学方程式为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是
SnI4制备SnI4。下列说法错误的是
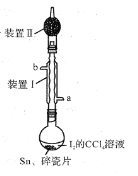
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】风靡全球的饮料果醋中含有苹果酸(MLA),其分子式为C4H6O5。0.1mol苹果酸与足量的NaHCO3溶液反应能产生4.48LCO2(标准状况),苹果酸脱水能生成使溴水褪色的产物。苹果酸经聚合生成聚苹果酸酯(PMLA)。
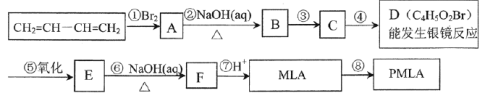
(1)写出物质的结构简式:A___,D___。
(2)指出合成路线中①、②的反应类型:①___;②___。
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式:___。
(4)写出E→F转化的化学方程式___。
(5)上述转化关系中步骤③和④的顺序能否颠倒?___(填“能”或“不能”)。说明理由:___。
(6)请写出以丙烯为原料制备乳酸(2-羟基丙酸)的合成路线流程图(无机试剂任取)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四组物质,用横线上所给的试剂常温下就能鉴别出来的是( )
A.FeO、FeS、CuO、CuS、稀硫酸
B.苯、四氯化碳、无水乙醇、己烯 溴水
C.甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液
D.苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.
完成下列填空:
(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.
(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.
(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO的杀菌能力比ClO﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).
(4)在氯水中,下列关系正确的是__(选填编号).
a c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)
b c(H+)=c(ClO﹣)+c(Cl﹣)+c(OH﹣)
c c(HClO)<c(Cl﹣)
d c(Cl﹣)<c(OH﹣)
(5)ClO2是一种更高效、安全的消毒剂,工业上可用ClO2与水中的MnCl2在常温下反应,生成MnO2和盐酸,以除去水中Mn2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 丙烯与氯化氢加成的产物有2种 B. 联二苯![]() 的二氯取代物有15种
的二氯取代物有15种
C. 立方烷![]() 的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成芳香族有机高聚物P的合成路线.
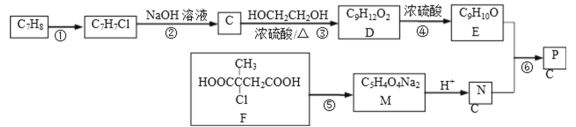
已知:ROH+R’OH![]() ROR’+H2O
ROR’+H2O
完成下列填空:
(1)F中官能团的名称__;写出反应①的反应条件__;
(2)写出反应⑤的化学方程式__.
(3)写出高聚物P的结构简式__.
(4)E有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式__.
①分子中只有苯环一个环状结构,且苯环上有两个取代基;
②1mol该有机物与溴水反应时消耗4molBr2
(5)写出以分子式为C5H8的烃为主要原料,制备F的合成路线流程图(无机试剂任选)__.合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3.
CH3COOCH2CH3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)Si(s)+2CO(g)
②Si(s)+2Cl2(g)SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______种自旋方向;SiO2晶体中每个硅原子与______个氧原子直接相连.
(2)单质的还原性:碳______硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______.
(3)反应②生成的化合物分子空间构型为;该分子为______分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______(用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g)![]() Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______、______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种高效氧化剂可用来氧化吸附有机异味物.也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的_______区,基态Mn2+的核外电子排布式可表示为_____。
(2)1 mol [Mn( H2O)6]2+中所含有的共价键数目为__________。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为_______.C2O42-中碳原子的轨道杂化类型是___________________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是__________。
(5)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
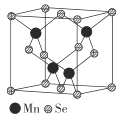
①β-MnSe中Mn的配位数为_____________。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为______pm, β-MnSe 的密度ρ= ______ ( 列出表达式)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com