
����Ŀ��Cl2���仯�����������������о��й㷺����;������������ˮ���γ���������ˮ��ϵ��
���������գ�
��1����ԭ���������ӵĵ����Ų�ʽ��__��������Ų�ʽ��ȣ������ʾʽ�����˶Ժ�������˶�״̬��__������
��2���⡢�ȡ�������Ԫ�ظ����γ�һ�ּ������ӣ������Ӱ뾶�ɴ�С��˳��������Щ����__��
��3����������ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ����ֱ���ƽ�ⷽ��ʽ��ʾ��__����֪HClO��ɱ��������ClO��ǿ���ȴ�������ˮʱ�����ļ���ɱ��Ч�����ڶ��������ԭ����__��һ��ԭ�ɣ���
��4������ˮ�У����й�ϵ��ȷ����__��ѡ���ţ���
a c��HClO��+c��ClO����=c��H+����c��OH����
b c��H+��=c��ClO����+c��Cl����+c��OH����
c c��HClO����c��Cl����
d c��Cl������c��OH����
��5��ClO2��һ�ָ���Ч����ȫ������������ҵ�Ͽ���ClO2��ˮ�е�MnCl2�ڳ����·�Ӧ������MnO2�����ᣬ�Գ�ȥˮ��Mn2+��д���÷�Ӧ�Ļ�ѧ����ʽ������ƽ��__��������Ϊ����MnO2������������Ӧ����������������ʶ����__����������������������˵������__��
���𰸡�3s23p5 �������� Cl����O2����H�� Cl2��aq��+H2O![]() HClO+H++Cl����HClO
HClO+H++Cl����HClO![]() H++ClO����Cl2��g��
H++ClO����Cl2��g��![]() Cl2��aq�� �ļ��¶ȸߣ�HClO�ֽ⣬ɱ��Ч�����ڶ����� bc 2ClO2+5MnCl2+6H2O=5MnO2+12HCl �� MnO2��Ũ������ȵ������²��ܷ�Ӧ
Cl2��aq�� �ļ��¶ȸߣ�HClO�ֽ⣬ɱ��Ч�����ڶ����� bc 2ClO2+5MnCl2+6H2O=5MnO2+12HCl �� MnO2��Ũ������ȵ������²��ܷ�Ӧ
��������
��1������17��Ԫ�أ����������ӵĵ����Ų�ʽΪ![]() �����ù����ʾʽ���������������������ӵ���������
�����ù����ʾʽ���������������������ӵ���������
��2��![]() �൱�ڹ�ͺͺ�����ӣ�
�൱�ڹ�ͺͺ�����ӣ�![]() ������ǰ������ӣ���
������ǰ������ӣ���![]() ������ǰ������ӣ��뾶�ɴ�СΪ
������ǰ������ӣ��뾶�ɴ�СΪ![]() ��
��
��3���������������ܽ⡪�ӷ�ƽ�⣬��![]() ������������ܺ�ˮ�������淴Ӧ����
������������ܺ�ˮ�������淴Ӧ����![]() ����
����![]() ��һ�����ᣬ���ڵ���ƽ��
��һ�����ᣬ���ڵ���ƽ��![]() �� �ļ��Ͷ��������������¶ȣ�����֪��
�� �ļ��Ͷ��������������¶ȣ�����֪��![]() �����ֽ⣬���ɱ��Ч����
�����ֽ⣬���ɱ��Ч����
��4��a.��Һ�д��������غ�![]() ����Ҫa���������
����Ҫa���������![]() �����Ƕ��߲�������ȣ�a�����
�����Ƕ��߲�������ȣ�a�����
b.�����Һ�д��ڵ������غ㣬b����ȷ��
c.������ˮ��Ӧ�õ�������![]() ��
��![]() ��
��![]() ��ǿ�������ȫ���룬�����Һ��
��ǿ�������ȫ���룬�����Һ��![]() �����������ɵ�
�����������ɵ�![]() ��������
��������![]() ��������ʲ��ֵ��룬���ʣ���
��������ʲ��ֵ��룬���ʣ���![]() ��Ũ�Ƚ�С��
��Ũ�Ƚ�С��![]() ��Ũ�ȣ�c����ȷ��
��Ũ�ȣ�c����ȷ��
d.��ˮ�����ԣ������Һ�е�![]() ���ͣ�������
���ͣ�������![]() ������˲����ܳ���
������˲����ܳ���![]() �������d�����
�������d�����
��ѡbc��
��5��![]() ����������
����������![]() ����ԭ�������߷���������ԭ��Ӧ
����ԭ�������߷���������ԭ��Ӧ![]() ���÷�Ӧ�õ��������ϡ����û�м��ȣ���˲�̫���ܱ�
���÷�Ӧ�õ��������ϡ����û�м��ȣ���˲�̫���ܱ�![]() �������������������Ӧ����һ����ֹͣ�ˡ�
�������������������Ӧ����һ����ֹͣ�ˡ�


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�����������װ����ͼ��ʾ�������������������գ�
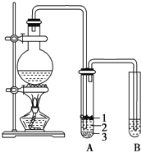
��1��Բ����ƿ�м���ķ�Ӧ�����廯�ơ��Ҵ� ��1:1�����ᡣ���������1:1���������õ�����Ϊ ________��ѡ���ţ���
a ��ƽ b ��Ͳ c ����ƿ d �ձ�
��2��д������ʱ��ƿ�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ ___________________ ��
��3���� �����ﵼ��ʢ�б�ˮ�������Թ�A�У���ˮ������������________���Թ�A�е����ʷ�Ϊ���㣨��ͼ��ʾ���������ڵ�____�㡣
��4���Թ�A�г��˲����ˮ֮�⣬�����ܴ��� ________ ��_________ ��д���ṹ��ʽ����
��5����Ũ�������ʵ�飬���Թ�A�л�õ��л�����ػ�ɫ����ȥ�������ʵ���ѷ����� ___________��ѡ���ţ���
a ���� b ����������Һϴ�� c �����Ȼ�̼��ȡ d ������������Һϴ��
���Թ�B�е����Ը��������Һ��ɫ��ʹ֮��ɫ������������_________��
��6��ʵ��Ա��ʦ���������װ���е��������Ӳ������ܸijɱ������ӿڣ���ԭ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�صĻ������ڹ�ũҵ�Լ������Ƽ�����;�㷺����Ҳ��Ի��������Ⱦ�������ˮ����������ɵĵ���Ⱦ�ѳ�Ϊһ�������ԵĻ������⡣
��1���������˷ɴ��Ļ���ƽ����г����£�N2H4����ȼ�ϡ�NH3��NaClO��Ӧ�ɵõ��£�N2H4�����÷�Ӧ�б������뱻��ԭ��Ԫ�ص�ԭ�Ӹ���֮��Ϊ___�������Ӧ����5mol���ӷ���ת�ƣ��ɵõ�___ g�¡�
��2����������25mL0.01mol/Lϡ�����л���ͨ��5.6mLNH3����״������Һ����仯���Բ��ƣ�����Ӧ����Һ������Ũ���ɴ�С��˳����___����ͨ��NH3�Ĺ�������Һ�ĵ�������___����д�������������С��������������������
��3����������Һ�м���ͨ��NH3���ù���������Ũ�ȴ�С��ϵ������ȷ����___��ѡ���ţ���
a��[Cl-]=[NH4+]��[H+]=[OH-] b��[Cl-]��[NH4+]=[H+]��[OH-
c��[NH4+]��[OH-]��[Cl-]��[H+] d��[OH-]��[NH4+]��[H+]��[Cl-]
��4����������25mL��HCl0.01mol����Һ�еμӰ�ˮ���������ù�����ˮ�ĵ���ƽ�⣨��д����ƽ���ƶ������___�����μӰ�ˮ��25mLʱ�������Һ��ˮ�ĵ���������ˮ��Ũ��Ϊ___mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ���Ƕ�����Ԫ�أ�������Ԫ�����ڱ��е����λ����ͼ��ʾ������
���Ƕ�����Ԫ�أ�������Ԫ�����ڱ��е����λ����ͼ��ʾ������![]() ��
��![]() �γɵ�һ�ֻ�������ʹƷ����Һ��ɫ������˵����ȷ���ǣ� ��
�γɵ�һ�ֻ�������ʹƷ����Һ��ɫ������˵����ȷ���ǣ� ��

A.![]() ��
��![]() �γɵ����ֳ����������к��еĻ�ѧ������ȫ����ͬ
�γɵ����ֳ����������к��еĻ�ѧ������ȫ����ͬ
B.����![]() ��Һ��ȥ
��Һ��ȥ![]() �����л��е�
�����л��е�![]() ����
����
C.���⻯������ȶ��ԣ�![]()
D.������![]() ��
��![]() �У������Ӱ뾶�����������Ӱ뾶
�У������Ӱ뾶�����������Ӱ뾶
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��Ӧ�Ļ�ѧ��������ǣ�������
A.������Һ����ϴ���ۣ�CO32��+H2OHCO3��+OH��
B.����FeSO4��Һʱ�������������ۣ�Fe3++Fe��2Fe2+
C.��1molNaOH��1molNa2CO3�Ļ����Һ�е��뺬1.5molHCl��ϡ���2OH��+CO32��+3H+��HCO3��+2H2O
D.NH4Al(SO4)2��Һ�е���Ba(OH)2��Һ��SO42��ǡ�ó�����ȫ��2Ba2++4OH��+Al3++2SO42����2BaSO4��+AlO2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̬����![]() ��
��![]() ����֪
����֪![]() ��
��![]() ������ԭ�Ӹ�����ȣ�������֮��Ϊ
������ԭ�Ӹ�����ȣ�������֮��Ϊ![]() ��
��![]() ��
��![]() ��ԭ�Ӻ�����������������������
��ԭ�Ӻ�����������������������![]() ԭ��
ԭ��![]() ���������
���������![]() ���3����
���3����
��1��![]() ��
��![]() ��Ԫ�ط��ŷֱ�Ϊ_______��
��Ԫ�ط��ŷֱ�Ϊ_______��
��2��![]() �е�
�е�![]() ֵΪ_______��
ֵΪ_______��
��3��![]() ���ܲ���ĿΪ_______��
���ܲ���ĿΪ_______��
��4��![]() ��
��![]() �γɵ�һ����̬��������ˮ��Ӧ��������
�γɵ�һ����̬��������ˮ��Ӧ��������![]() ��
��![]() �γɵ���һ����̬�����д���÷�Ӧ�Ļ�ѧ����ʽ��_______��
�γɵ���һ����̬�����д���÷�Ӧ�Ļ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ͭ��ϡ���ᷴӦ����̬�������Ƿ�NO2����������ʵ�飮
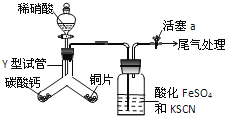
��֪��FeSO4+NO��[Fe��NO��]SO4���÷�Ӧ�ϻ�����������һ����[Fe��NO��]2+ʱͻ��������ɫ��
��1��ʵ��ǰ�����װ�õ������ԣ���������__��
��2��ʵ�鿪ʼʱ�Ƚ�Y���Թ���ʢ��̼��Ƶ�֧����б����������ϡ���ᣬ��ʵ�������Ŀ����__��ͭƬ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ__��
��3��ϴ��ƿ�м���KSCN��Һ��Ŀ�ļ�ԭ����__����ʵ��ֻ�۲쵽ϴ��ƿ�г�������ɫ��д��β�������Ļ�ѧ����ʽ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��������ʵ�������ȷ����
A.NaHSˮ�ⷴӦ��HS-+H2O![]() H3O++S2-
H3O++S2-
B.Fe(OH)2��ϡ���ᷴӦ��2H++Fe(OH)2=Fe2��+2H2O
C.Na2CO3ˮ��Һ�д���ƽ�⣺CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
D.BaSO4��ˮ��Һ�����Լ�����BaSO4![]() Ba2++SO42-
Ba2++SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһԪ����(��HA��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�HA![]() H����A�����ش��������⣺
H����A�����ش��������⣺
��1������Һ�м�������NaA���壬����ƽ�⽫��________(����������������)��Ӧ�����ƶ���������________ ��
��2��������Һ�м�������NaCl��Һ������ƽ�⽫��______(����������������)��Ӧ�����ƶ�����Һ��c(A��)��________(����������������С������������)����Һ��c(OH��)��________(����������������С������������)��
��3����25 ���£���a mol��L��1�İ�ˮ��0.01 mol��L��1������������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)��c(Cl-)������Һ��_______��(������������������������)���ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb��______ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com