
【题目】实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
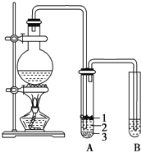
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸。配制体积比1:1的硫酸所用的仪器为 ________(选填编号)。
a 天平 b 量筒 c 容量瓶 d 烧杯
(2)写出加热时烧瓶中发生的主要反应的化学方程式 ___________________ 。
(3)将 生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________,试管A中的物质分为三层(如图所示),产物在第____层。
(4)试管A中除了产物和水之外,还可能存在 ________ ,_________ (写出结构简式)。
(5)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的最佳方法是 ___________(选填编号)。
a 蒸馏 b 氢氧化钠溶液洗涤 c 用四氯化碳萃取 d 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质名称是_________。
(6)实验员老师建议把上述装置中的仪器连接部分由橡胶管改成标准玻璃接口,其原因_________。
【答案】b NaBr+H2SO4+CH3CH2OH![]() CH3CH2Br+NaHSO4+H2O 冷凝、液封溴乙烷 3 CH2=CH2 CH3CH2OCH2CH3 d 乙烯 反应会产生Br2,腐蚀橡胶
CH3CH2Br+NaHSO4+H2O 冷凝、液封溴乙烷 3 CH2=CH2 CH3CH2OCH2CH3 d 乙烯 反应会产生Br2,腐蚀橡胶
【解析】
实验原理为圆底烧瓶中加入的反应物是溴化钠、乙醇和1:1的硫酸,加热进行反应制备溴乙烷,制备原理为:NaBr+H2SO4+CH3CH2OH![]() CH3CH2Br+NaHSO4+H2O,试管A中加入冰水冷凝液封得到溴乙烷,试管B对产物的成分进行探究验证。
CH3CH2Br+NaHSO4+H2O,试管A中加入冰水冷凝液封得到溴乙烷,试管B对产物的成分进行探究验证。
(1)配制体积比1:1的硫酸所用的仪器为量筒,答案选b;
(2)加热时烧瓶中发生的主要反应的化学方程式为NaBr+H2SO4+CH3CH2OH![]() CH3CH2Br+NaHSO4+H2O;
CH3CH2Br+NaHSO4+H2O;
(3)冰水混合物可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,所以也可液封溴乙烷,防止其挥发,产物在第3层;
(4)反应过程中会有HBr生成,在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中可能有HBr、CH3CH2OH;乙醇在浓硫酸加热的条件可以发生消去反应生成CH2=CH2,也可以分子间脱水生成CH3CH2OCH2CH3,即产物中也可能存在CH2=CH2,CH3CH2OCH2CH3;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦;氢氧化钠溶液易使溴乙烷水解;四氯化碳会引入新的杂质;而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以d正确;乙醇在浓硫酸加热的条件可以发生消去反应生成CH2=CH2,乙烯可以使高猛酸钾溶液褪色;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶,应用玻璃导管。


科目:高中化学 来源: 题型:
【题目】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。Mg(OH)2是一种常用的阻燃剂,生产工艺如下:
![]()
完成下列填空:
(1)精制卤水中的MgCl2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClxmH2O],反应的化学方程式为___。
(2)合成反应后,继续在393K~523K下水热处理8h,发生反应:Mg(OH)2-xClxmH2O→(1-![]() )Mg(OH)2+
)Mg(OH)2+![]() MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
MgCl2+mH2O,水热处理后,进行过滤、水洗。水洗的目的是___。
(3)阻燃型Mg(OH)2具有晶粒大,易分散、与高分子材料相容性好等特点。上述工艺流程中与此有关的步骤是___。
(4)已知热化学方程式:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJmol-1
Al(OH)3(s)→![]() Al2O3(s)+
Al2O3(s)+![]() H2O(g)-87.7kJmol-1
H2O(g)-87.7kJmol-1
Mg(OH)2和Al(OH)3起阻燃作用的主要原因是___。等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是___,原因是___。
(5)该工业生产的原料还可以用来提取金属镁。请设计提取金属镁的工艺流程(框内写产物名称,箭头上标明转化条件):___
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是

A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
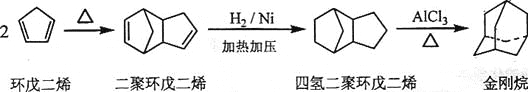
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
请回答下列问题:
(1)环戊二烯分子中最多有___个原子共平面;
(2)金刚烷的分子式为___________,其分子中的CH2基团有______个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
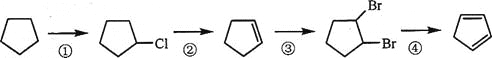
其中,反应①的产物名称是__________,反应②的反应试剂和反应条件是__________,反应③的反应类型是__________;
(4)已知烯烃能发生如下反应:
![]()
请写出下列反应产物的结构简式: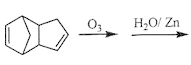 __________;
__________;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(-CH3,-CH2R,-CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出A所有可能的结构简式(不考虑立体异构):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液均为![]() ,有关叙述正确的是( )
,有关叙述正确的是( )
A.碳酸氢钠溶液中![]()
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中![]()
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是
SnI4制备SnI4。下列说法错误的是
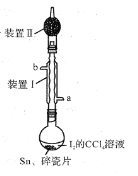
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是
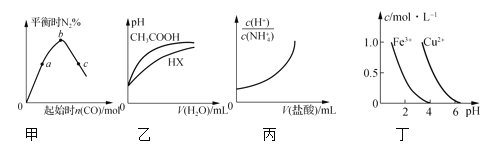
A.图甲表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
B.图乙表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
C.图丙表示25℃时,向0.1 mol·L-1NH4Cl溶液中滴加0.1 mol·L-1盐酸,溶液随盐酸体积的变化关系
D.根据图丁,若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.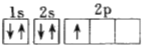
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
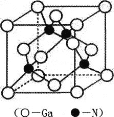
①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______gcm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2及其化合物在生产、生活中具有广泛的用途.将氯气溶于水能形成氯气﹣氯水体系.
完成下列填空:
(1)氯原子最外层电子的电子排布式是__.与电子排布式相比,轨道表示式增加了对核外电子运动状态中__描述.
(2)氢、氯、氧三种元素各能形成一种简单阴离子,按离子半径由大到小的顺序排列这些离子__.
(3)氯气﹣氯水体系中,存在多个含氯元素的平衡关系,请分别用平衡方程式表示:__.已知HClO的杀菌能力比ClO﹣强,氯处理饮用水时,在夏季的杀菌效果比在冬季差,可能原因是__(一种原因即可).
(4)在氯水中,下列关系正确的是__(选填编号).
a c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)
b c(H+)=c(ClO﹣)+c(Cl﹣)+c(OH﹣)
c c(HClO)<c(Cl﹣)
d c(Cl﹣)<c(OH﹣)
(5)ClO2是一种更高效、安全的消毒剂,工业上可用ClO2与水中的MnCl2在常温下反应,生成MnO2和盐酸,以除去水中Mn2+,写出该反应的化学方程式(需配平)__.有人认为产物MnO2和盐酸会继续反应生成氯气,这种认识对吗?__(填“对”或“错”),说明理由__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com