
【题目】下列图示与对应的叙述正确的是
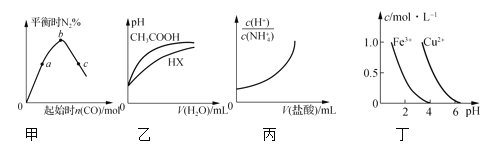
A.图甲表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
B.图乙表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
C.图丙表示25℃时,向0.1 mol·L-1NH4Cl溶液中滴加0.1 mol·L-1盐酸,溶液随盐酸体积的变化关系
D.根据图丁,若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
【答案】AC
【解析】
A. 反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),增大CO的浓度,平衡正向移动,NO2的转化率增大,所以NO2的转化率:c>b>a,故A正确 ;
N2(g)+4CO2(g),增大CO的浓度,平衡正向移动,NO2的转化率增大,所以NO2的转化率:c>b>a,故A正确 ;
B. 酸性越强,加水稀释相同倍数,pH的变化越大,根据图示,稀释过程中酸性CH3COOH>HX,所以25℃时HX的电离平衡常数小于CH3COOH的电离平衡常数,故B错误;
C. NH4+的水解平衡常数![]() ,向0.1 mol·L-1NH4Cl溶液中滴加0.1 mol·L-1盐酸,抑制铵根离子水解,一水合氨的浓度减小,所以
,向0.1 mol·L-1NH4Cl溶液中滴加0.1 mol·L-1盐酸,抑制铵根离子水解,一水合氨的浓度减小,所以![]() 增大,故C正确;
增大,故C正确;
D. 根据图丁,若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在4左右,防止铜离子沉淀,故D错误。
答案选AC。


科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1molA和1molB进行反应:2A(g)+B(g)![]() 2C(g),达到平衡时生成0.6molC。下列说法正确的是( )
2C(g),达到平衡时生成0.6molC。下列说法正确的是( )
A.当容器内密度保持不变时,可以判断反应已达到平衡
B.其他条件不变,将容器体积变为5L,C的平衡浓度变为原来的2倍
C.达到平衡时,C的体积百分含量为0.353
D.其他条件不变,若增大压强,则物质A的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种综合处理SO2废气的工艺流程。若每步反应都完全,下列说法正确的是( )
(设反应过程中溶液的体积不变)
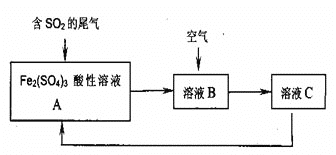
A.溶液B中发生的反应为:2SO2+O2→2SO3
B.由反应过程可推知氧化性:O2>Fe3+>SO42-
C.溶液的pH:A>B>C
D.A与C溶液成分相同,但浓度之比不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
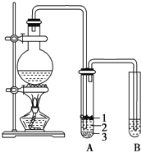
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸。配制体积比1:1的硫酸所用的仪器为 ________(选填编号)。
a 天平 b 量筒 c 容量瓶 d 烧杯
(2)写出加热时烧瓶中发生的主要反应的化学方程式 ___________________ 。
(3)将 生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________,试管A中的物质分为三层(如图所示),产物在第____层。
(4)试管A中除了产物和水之外,还可能存在 ________ ,_________ (写出结构简式)。
(5)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的最佳方法是 ___________(选填编号)。
a 蒸馏 b 氢氧化钠溶液洗涤 c 用四氯化碳萃取 d 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质名称是_________。
(6)实验员老师建议把上述装置中的仪器连接部分由橡胶管改成标准玻璃接口,其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是
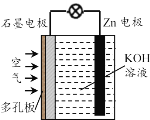
A.该电池放电时OH—向石墨电极移动
B.放电时氧气在石墨电极上发生还原反应
C.该电池在充电时Zn电极应与电源正极相连
D.该电池的负极反应为:Zn + H2O-2e—=ZnO + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500℃时,在四个体积为2L的恒容密闭容器中发生反应:NO2(g) + SO2(g)![]() SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
容器 | 起始时物质的量/mol | |||
NO2 | SO2 | SO3 | NO | |
甲 | 0.1 | 0.1 | 0 | 0 |
乙 | 0.15 | 0.05 | 0.05 | 0.05 |
丙 | 0 | 0 | 0.2 | 0.2 |
丁 | 0.1 | 0.2 | 0 | 0 |
已知甲容器达到平衡时容器中c(SO3)=0.01mol·L-1。下列说法正确的是
A.升温至700℃,上述反应的平衡常数为![]() ,则正反应为吸热反应
,则正反应为吸热反应
B.达平衡时,容器丙中c(SO2)是容器甲的2倍
C.达平衡时,容器丁中c(NO)与乙容器中相同
D.保持温度不变容器甲达到平衡时再充入SO2(g)和SO3(g)各0.02mol,此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀的溶解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.1 mol·L-1的NaHSO3溶液的pH约为4.0,请分析NaHSO3溶液显酸性的原因____。
(2)实验室配制FeCl3溶液时,需将FeCl3溶解在较浓盐酸中,然后加水稀释,这样操作的目的是____。
(3)KCN溶液中存在CN—+H2O![]() HCN+OH—,该反应在 25℃时的平衡常数K=____。(已知:25℃时,Ka(HCN)=6.25×10—10)
HCN+OH—,该反应在 25℃时的平衡常数K=____。(已知:25℃时,Ka(HCN)=6.25×10—10)
(4)已知25℃,Kb(NH3·H2O)=1.8×10-5,H2CO3的Ka1=4.2×10-7、Ka2=4.7×10-11。则NH4HCO3溶液的pH____(填“>、<或=”)7。
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表所示(H+和OH—未列出)
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl— |
浓度/mol·L-1 | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a____0.16(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
(1)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为___。如果反应中有5mol电子发生转移,可得到___ g肼。
(2)常温下向25mL0.01mol/L稀盐酸中缓缓通入5.6mLNH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是___。在通入NH3的过程中溶液的导电能力___(填写“变大”、“变小”或“几乎不变”)。
(3)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是___(选填编号)。
a.[Cl-]=[NH4+]>[H+]=[OH-] b.[Cl-]>[NH4+]=[H+]>[OH-
c.[NH4+]>[OH-]>[Cl-]>[H+] d.[OH-]>[NH4+]>[H+]>[Cl-]
(4)常温下向25mL含HCl0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡(填写电离平衡移动情况)___。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.
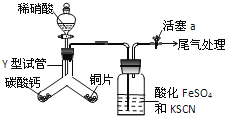
已知:FeSO4+NO→[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.
(1)实验前需检验装置的气密性,简述操作__.
(2)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是__;铜片和稀硝酸反应的化学方程式为__.
(3)洗气瓶中加入KSCN溶液的目的及原理是__;本实验只观察到洗气瓶中出现了棕色,写出尾气处理的化学方程式__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com