
【题目】500℃时,在四个体积为2L的恒容密闭容器中发生反应:NO2(g) + SO2(g)![]() SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
容器 | 起始时物质的量/mol | |||
NO2 | SO2 | SO3 | NO | |
甲 | 0.1 | 0.1 | 0 | 0 |
乙 | 0.15 | 0.05 | 0.05 | 0.05 |
丙 | 0 | 0 | 0.2 | 0.2 |
丁 | 0.1 | 0.2 | 0 | 0 |
已知甲容器达到平衡时容器中c(SO3)=0.01mol·L-1。下列说法正确的是
A.升温至700℃,上述反应的平衡常数为![]() ,则正反应为吸热反应
,则正反应为吸热反应
B.达平衡时,容器丙中c(SO2)是容器甲的2倍
C.达平衡时,容器丁中c(NO)与乙容器中相同
D.保持温度不变容器甲达到平衡时再充入SO2(g)和SO3(g)各0.02mol,此时v(正)>v(逆)
【答案】BC
【解析】
500℃时,甲容器达到平衡时容器中c(SO3)=0.01mol·L-1;

500℃时,![]() 。
。
A. 500℃时,平衡常数是![]() ,升温至700℃,上述反应的平衡常数为
,升温至700℃,上述反应的平衡常数为![]() ,说明升高温度平衡逆向移动,则正反应为放热反应,故A错误;
,说明升高温度平衡逆向移动,则正反应为放热反应,故A错误;
B. 根据“一边倒”原则,丙中相当于投入0.2mol NO2(g) 和0.2mol SO2(g),投料为甲的2倍,相当于加压,加压平衡不移动,达平衡时,所以容器丙中c(SO2)是容器甲的2倍,故B正确;
C. 根据“一边倒”原则,乙相当于都是投入0.2mol NO2(g)和0.1mol SO2(g),与丁是等效平衡关系,因此达平衡时,容器丁中c(NO)与乙容器中相同,故C正确;
D. 保持温度不变,容器甲达到平衡时再充入SO2(g)和SO3(g)各0.02mol, >K,此时v(正)<v(逆),故D错误。
>K,此时v(正)<v(逆),故D错误。
答案选BC。


科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料,已知25℃,101KPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) △H=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式为___。
(2)某温度时水的离子积Kw=1.0×10-13,则该温度时纯水的pH__7(填“>”、“<”或“=”)。该温度下,pH=2的CH3COOH溶液中,c(OH-)=__。
(3)向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2SO3固体(忽略体积变化),则CH3COO-浓度的变化依次为___、___(填“减小”“增大”或“不变”)。
(4)同浓度的NaA和NaB两种溶液pH前者大于后者,比较两份溶液中所含阴离子总浓度大小为c(NaA)__c(NaB)(填“>”、“<”或“=“)。
(5)25℃时,某溶液中Fe3+的浓度为0.010mol/L,使Fe3+恰好完全沉淀的pH为__。(已知:当离子浓度小于或等于10-5mol/L认为完全反应;Ksp[Fe(OH)3]=8×10-38,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
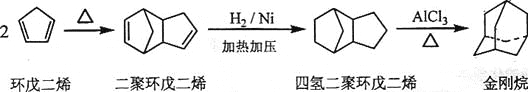
请回答下列问题:
(1)环戊二烯分子中最多有___个原子共平面;
(2)金刚烷的分子式为___________,其分子中的CH2基团有______个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:
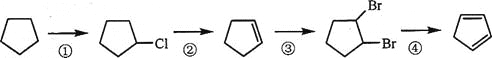
其中,反应①的产物名称是__________,反应②的反应试剂和反应条件是__________,反应③的反应类型是__________;
(4)已知烯烃能发生如下反应:
![]()
请写出下列反应产物的结构简式: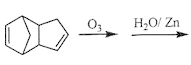 __________;
__________;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(-CH3,-CH2R,-CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出A所有可能的结构简式(不考虑立体异构):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2![]() SnI4制备SnI4。下列说法错误的是
SnI4制备SnI4。下列说法错误的是
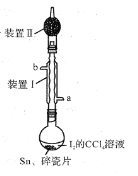
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是
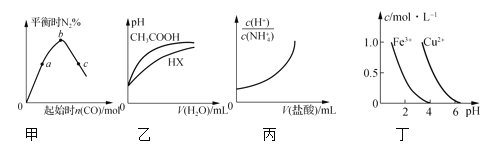
A.图甲表示反应4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
N2(g)+4CO2(g),保持其他条件不变,改变CO的物质的量,平衡时N2的体积分数变化情况。由图可知,NO2的转化率:c>b>a
B.图乙表示25℃时,分别加水稀释体积均为100 mL、pH=2的CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH的电离平衡常数
C.图丙表示25℃时,向0.1 mol·L-1NH4Cl溶液中滴加0.1 mol·L-1盐酸,溶液随盐酸体积的变化关系
D.根据图丁,若要除去CuSO4溶液中的Fe3+,需要调节溶液的pH在7左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL1mol·L-1的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )
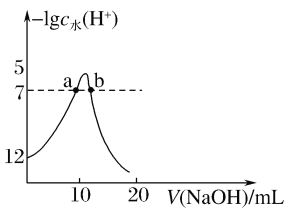
A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.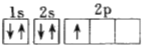
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
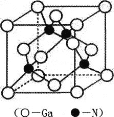
①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______gcm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】风靡全球的饮料果醋中含有苹果酸(MLA),其分子式为C4H6O5。0.1mol苹果酸与足量的NaHCO3溶液反应能产生4.48LCO2(标准状况),苹果酸脱水能生成使溴水褪色的产物。苹果酸经聚合生成聚苹果酸酯(PMLA)。
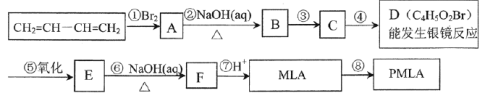
(1)写出物质的结构简式:A___,D___。
(2)指出合成路线中①、②的反应类型:①___;②___。
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式:___。
(4)写出E→F转化的化学方程式___。
(5)上述转化关系中步骤③和④的顺序能否颠倒?___(填“能”或“不能”)。说明理由:___。
(6)请写出以丙烯为原料制备乳酸(2-羟基丙酸)的合成路线流程图(无机试剂任取)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成芳香族有机高聚物P的合成路线.
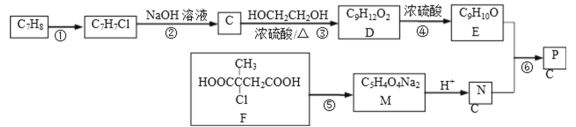
已知:ROH+R’OH![]() ROR’+H2O
ROR’+H2O
完成下列填空:
(1)F中官能团的名称__;写出反应①的反应条件__;
(2)写出反应⑤的化学方程式__.
(3)写出高聚物P的结构简式__.
(4)E有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式__.
①分子中只有苯环一个环状结构,且苯环上有两个取代基;
②1mol该有机物与溴水反应时消耗4molBr2
(5)写出以分子式为C5H8的烃为主要原料,制备F的合成路线流程图(无机试剂任选)__.合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3.
CH3COOCH2CH3.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com