
����Ŀ������Ҫ����գ�
��1��FeSO4��ת��ΪFeCO3��FeCO3�ڿ����м��ȿ��Ƶ���ϵ��������ϣ���֪25�棬101KPaʱ��4Fe��s��+3O2��g��=2Fe2O3��s�� ��H=-1648kJ/mol
C��s��+O2��g��=CO2��g�� ��H=-393kJ/mol
2Fe��s��+2C��s��+3O2��g��=2FeCO3��s�� ��H=-1480kJ/mol
FeCO3�ڿ����м��ȷ�Ӧ����Fe2O3���Ȼ�ѧ����ʽΪ___��
��2��ij�¶�ʱˮ�����ӻ�Kw=1.0��10-13������¶�ʱ��ˮ��pH__7����������������������=���������¶��£�pH=2��CH3COOH��Һ�У�c��OH-��=__��
��3����2��0.1mol/LCH3COONa��Һ�зֱ��������NH4NO3��Na2SO3���壨��������仯������CH3COO-Ũ�ȵı仯����Ϊ___��___��������С������������������������
��4��ͬŨ�ȵ�NaA��NaB������ҺpHǰ�ߴ��ں��ߣ��Ƚ�������Һ��������������Ũ�ȴ�СΪc��NaA��__c��NaB������������������������=������
��5��25��ʱ��ij��Һ��Fe3+��Ũ��Ϊ0.010mol/L��ʹFe3+ǡ����ȫ������pHΪ__������֪��������Ũ��С�ڻ����10-5mol/L��Ϊ��ȫ��Ӧ��Ksp[Fe��OH��3]=8��10-38��lg2=0.3��
���𰸡�4FeCO3(s)+O2(g)��2Fe2O3(s)+4CO2(g) ��H��260 kJmol-1 �� 1.0��1011molL1 ��С ���� �� 3.3
��������
�Ÿ��ݸ�˹���ɣ��õ��Ȼ�ѧ����ʽ���ʱ䡣
���¶ȵ���Ϊ���ȷ�Ӧ��ij�¶�ʱˮ�����ӻ��볣�±Ƚϣ��ó���Һ��������Ũ�ȴ�С��ϵ��������¶���pH��2��CH3COOH��Һ��������Ũ�ȡ�
��CH3COONaˮ���Լ��ԣ�NH4NO3ˮ�������ԣ�������ٽ��������ˮ��ƽ�������ƶ���CH3COONaˮ���Լ��ԣ�Na2SO3ˮ���Լ��ԣ���������ƣ������ˮ��ƽ�������ƶ���
�ȸ���ˮ��̶ȴ�С���͵���غ�ó���������Ũ�ȹ�ϵ��
�ɸ����ܶȻ�����ʹFe3+ǡ����ȫ����ʱ������Ũ�ȣ��ټ���������Ũ�ȣ������pHֵ��
�Ÿ��ݸ�˹���ɣ���һ������ʽ���ϵڶ�������ʽ��4������ȥ����������ʽ��2�����õ�4FeCO3(s)+O2(g)��2Fe2O3(s)+4CO2(g) ��H��1648kJmol-1+4��(393 kJmol-1) 2��(1480 kJmol-1) ��260 kJmol-1���ʴ�Ϊ��4FeCO3(s)+O2(g)��2Fe2O3(s)+4CO2(g) ��H��260 kJmol-1��
�Ƶ���Ϊ���ȷ�Ӧ��ij�¶�ʱˮ�����ӻ�Kw��1.0��1013>1.0��1014��˵����Һ��������Ũ�ȴ���107molL1�����Ըô�ˮ��pHС��7�����¶��£�pH��2��CH3COOH��Һ�У�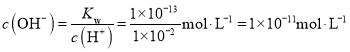 ���ʴ�Ϊ������1.0��1011molL1��
���ʴ�Ϊ������1.0��1011molL1��
����2��0.1 molL1CH3COONa��Һ�м�������NH4NO3��CH3COONaˮ���Լ��ԣ�NH4NO3ˮ�������ԣ�������ٽ��������ˮ��ƽ�������ƶ������CH3COO��Ũ�ȼ�С��CH3COONaˮ���Լ��ԣ�Na2SO3ˮ���Լ��ԣ���������ƣ������ˮ��ƽ�������ƶ������CH3COO��Ũ�����ʴ�Ϊ����С������
��ͬŨ�ȵ�NaA��NaB������ҺpHǰ�ߴ��ں��ߣ�˵��ǰ��ˮ��̶ȴ���ǿ��������Ũ�ȴ�������Ũ��С���������ߵ���غ㣺![]() ��
��![]() ��ǰ��������Ũ��С������������Ũ�ȶ���ȣ����ǰ�ߵ���������Ũ��С���ʴ�Ϊ������
��ǰ��������Ũ��С������������Ũ�ȶ���ȣ����ǰ�ߵ���������Ũ��С���ʴ�Ϊ������
��25��ʱ��ij��Һ��Fe3+��Ũ��Ϊ0.010 molL1��ʹFe3+ǡ����ȫ����, ![]() ��
��![]() ��
��![]() ��pH ��4lg5=3.3�������Һ��pHΪ3.3���ʴ�Ϊ��3.3��
��pH ��4lg5=3.3�������Һ��pHΪ3.3���ʴ�Ϊ��3.3��


 Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д� ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������õķ���ʴ�ԣ��ڹ�����ҵ���зdz���Ҫ�����á����������գ�
��1����ԭ�Ӻ����������___�ֲ�ͬ����չ������___�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2���أ�Ga������ͬ�塣д���ص��Ȼ���Ͱ�ˮ��Ӧ�Ļ�ѧ����ʽ___��
��3��������ͬ���ڡ�SiO2�ǹ����β�����Na2CaSi6O14������Ҫ�ɷ֣�Na2CaSi6O14Ҳ��д����������ʽ___��ʢ��NaOH��Һ���Լ�ƿ���ò���ƿ�������γ�ճ�ԵĹ����ζ�����������Ӧ�Ļ�ѧ����ʽΪ___����ʯ���������ᣬ��ͬ�ʯ����ԭ�ӵ����ʵ���������ͬ�����Ƴ�ʯ��ѧʽNaAlSi3O8����֪�Ƴ�ʯ�Ļ�ѧʽΪ___��
��4�������ͽ��������ﷴӦ�Ʊ����������ǹ�ҵ�ϳ��õķ������磺2Al��4BaO![]() 3Ba����BaOAl2O3��������Al�Ľ����Ա�Ba�Ľ�����___��ѡ����ǿ����������������������������ȡBa����Ҫԭ����___��
3Ba����BaOAl2O3��������Al�Ľ����Ա�Ba�Ľ�����___��ѡ����ǿ����������������������������ȡBa����Ҫԭ����___��
a������ʱAl�Ļ����Դ���Ba b������������BaO�ֽ�
c������ʱBaOAl2O3��Al2O3�ȶ� d��Ba�ķе��Al�ĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��10mLpH=11�İ�ˮ��ˮϡ����100mL�������ж���ȷ����
A.ϡ�ͺ���Һ��pH=7B.��ˮ�ĵ����������Һ���������ӵ�Ũ�Ⱦ���С
C.ϡ������![]() ����D.pH = 11��ˮ��Ũ��Ϊ0.001mol/L
����D.pH = 11��ˮ��Ũ��Ϊ0.001mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ҫ��������ʹҩ������������һ�ֺϳ�·�ߣ�
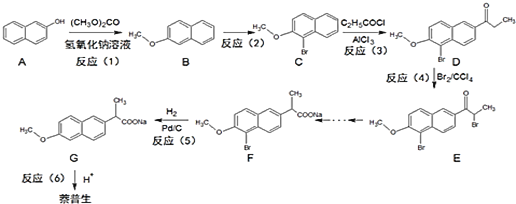
��֪������![]() ���Ļ�ѧ�����뱽���ơ�
���Ļ�ѧ�����뱽���ơ�
���������գ�
(1)��Ӧ(1)�ķ�Ӧ������___��A�ķ���ʽ��___��
(2)��Ӧ(2)���Լ���������___����Ӧ(3)�IJ�����D��___���ѧʽ����
(3)������������С�մ�ͬʱ���õ�ԭ����___���û�ѧ����ʽ��ʾ����
(4)X��Dһ��ͬ���칹�壬���������ص㣺
�������������������ȡ��������ͬһ�������ϣ�����NaOH��Һ����ȫˮ�⣬��������ˮ���������5�ֻ�ѧ������ͬ���⡣д��X���ܵĽṹ��ʽ___��
(5)���ñ���CH3COClΪԭ�Ϻϳɱ���ϩ�������Լ���ѡ��___��
���úϳ�·������ͼ��ʾΪ��A![]() B��
B��![]() Ŀ������
Ŀ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ10L���ܱ������У�1molA��1molB���з�Ӧ��2A(g)+B(g)![]() 2C(g)���ﵽƽ��ʱ����0.6molC������˵����ȷ���ǣ� ��
2C(g)���ﵽƽ��ʱ����0.6molC������˵����ȷ���ǣ� ��
A.���������ܶȱ��ֲ���ʱ�������жϷ�Ӧ�Ѵﵽƽ��
B.�����������䣬�����������Ϊ5L��C��ƽ��Ũ�ȱ�Ϊԭ����2��
C.�ﵽƽ��ʱ��C������ٷֺ���Ϊ0.353
D.�����������䣬������ѹǿ��������A��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĵ��ʼ��仯�������ʶ�������;�㷺�����������գ�
��ѧ�������о����ô������������ٷɻ�β���е�NO��COת���CO2��N2��2NO+2CO![]() 2CO2+N2+Q(Q��0)��
2CO2+N2+Q(Q��0)��
��ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�����±���
Ũ�ȣ�mol/L�� ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��CO�� | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��1���÷�Ӧƽ�ⳣ��K�ı���ʽΪ___���¶����ߣ�Kֵ___��ѡ��������������С��������������ǰ2s��ƽ����Ӧ����v��N2��=___�������߷�Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ��___��
��2����ҵ�ϳɰ��ķ�Ӧ�¶�ѡ��500�����ҵ�ԭ����___��
��3��ʵ�����ڹ̶��ݻ����ܱ������м���1mol������3mol����ģ�ҵ�ϳɰ�����Ӧ��һ���������Ѵﵽƽ��ı�־��___��
A.N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B.�����ڵ�ѹǿ���ֲ���
C.N2��H2��NH3��Ũ�Ȳ��ڱ仯
D.��Ӧֹͣ�������淴Ӧ�����ʶ�������
��4����������1molHCl��ϡ�����л���ͨ��1molNH3����Һ����仯���Բ��ƣ�����Ӧ��������Һ������Ũ���ɴ�С��˳����___����ͨ��NH3�Ĺ�������Һ�ĵ�������___��ѡ�������������С����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ���ñ��͵�NaCl��Һ��ʪ��pH��ֽ������Ǧ��о���缫����ֱͨ����Դ��һ��ʱ�����a�缫����ֽ�Ӵ�������һ��˫ɫͬ��Բ����ȦΪ��ɫ����Ȧ��dz��ɫ��������˵���������( )

A. b�缫������B. a�缫���Դ����������
C. ��������ˮ��������D. b�缫������Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ�٣�CO(g)��CuO(s) ![]() CO2(g)��Cu(s)�ͷ�Ӧ�ڣ�H2(g)��CuO(s)
CO2(g)��Cu(s)�ͷ�Ӧ�ڣ�H2(g)��CuO(s) ![]() Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ�ۣ�CO(g)��H2O(g)
Cu(s)��H2O(g)����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2�����¶��·�Ӧ�ۣ�CO(g)��H2O(g) ![]() CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(�� ��)
CO2(g)��H2(g)��ƽ�ⳣ��ΪK��������˵����ȷ����(�� ��)
A.��Ӧ�ٵ�ƽ�ⳣ��K1��![]()
B.��Ӧ�۵�ƽ�ⳣ��K��![]()
C.���ڷ�Ӧ�ۣ�����ʱ���¶����ߣ�H2Ũ�ȼ�С����÷�ӦΪ���ȷ�Ӧ
D.���ڷ�Ӧ�ۣ����º����£�����ѹǿ��H2Ũ��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��500��ʱ�����ĸ����Ϊ2L�ĺ����ܱ������з�����Ӧ��NO2(g) + SO2(g)![]() SO3(g)+ NO(g)���й�������ʼʱ�����ʵ����������±���ʾ��
SO3(g)+ NO(g)���й�������ʼʱ�����ʵ����������±���ʾ��
���� | ��ʼʱ���ʵ���/mol | |||
NO2 | SO2 | SO3 | NO | |
�� | 0.1 | 0.1 | 0 | 0 |
�� | 0.15 | 0.05 | 0.05 | 0.05 |
�� | 0 | 0 | 0.2 | 0.2 |
�� | 0.1 | 0.2 | 0 | 0 |
��֪�������ﵽƽ��ʱ������c(SO3)=0.01mol��L��1������˵����ȷ����
A.������700�棬������Ӧ��ƽ�ⳣ��Ϊ![]() ��������ӦΪ���ȷ�Ӧ
��������ӦΪ���ȷ�Ӧ
B.��ƽ��ʱ����������c(SO2)��������2��
C.��ƽ��ʱ����������c(NO)������������ͬ
D.�����¶Ȳ��������״ﵽƽ��ʱ�ٳ���SO2(g)��SO3(g)��0.02mol����ʱv(��)��v(��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com