
����Ŀ��������ˮ�п��ܴ��ڵ���ƽ�⡢ˮ��ƽ��ͳ������ܽ�ƽ��ȣ����Ƕ��ɿ�����ѧƽ�⡣�������ѧ��֪ʶ�ش�
��1��0.1 mol��L��1��NaHSO3��Һ��pHԼΪ4.0�������NaHSO3��Һ�����Ե�ԭ��____��
��2��ʵ��������FeCl3��Һʱ���轫FeCl3�ܽ��ڽ�Ũ�����У�Ȼ���ˮϡ�ͣ�����������Ŀ����____��
��3��KCN��Һ�д���CN��+H2O![]() HCN+OH�����÷�Ӧ�� 25��ʱ��ƽ�ⳣ��K=____������֪��25��ʱ��Ka(HCN)=6.25��10��10��
HCN+OH�����÷�Ӧ�� 25��ʱ��ƽ�ⳣ��K=____������֪��25��ʱ��Ka(HCN)=6.25��10��10��
��4����֪25�棬Kb(NH3��H2O)��1.8��10��5��H2CO3��Ka1��4.2��10��7��Ka2��4.7��10��11����NH4HCO3��Һ��pH____�����������=����7��
��5��ij�غ�ˮ��Ʒ��Na2FeO4�������������Ӽ���Ũ�ȼ��±���ʾ��H+��OH��δ�г���
���� | SO42- | Mg2+ | Fe3+ | Na+ | Cl�� |
Ũ��/mol��L��1 | a | 0.05 | 0.10 | 0.50 | 0.58 |
�����е�a____0.16�����������=������
���𰸡�NaHSO3�ĵ���̶ȴ�����ˮ��̶ȣ�����Һ������ ����FeCl3ˮ�� 1.6��10��5 �� ��
��������
��1��NaHSO3���������ʽ�Σ�HSO3-���ڵ���ƽ��HSO3-![]() SO32-+H+����������ԣ�HSO3-����ˮ��ƽ��HSO3-+H2O
SO32-+H+����������ԣ�HSO3-����ˮ��ƽ��HSO3-+H2O![]() H2SO3+OH-��ˮ��ʼ��ԣ�0.1 mol��L��1��NaHSO3��Һ��pHԼΪ4.0��˵��NaHSO3�ĵ���̶ȴ�����ˮ��̶ȣ�����Һ�����ԣ�
H2SO3+OH-��ˮ��ʼ��ԣ�0.1 mol��L��1��NaHSO3��Һ��pHԼΪ4.0��˵��NaHSO3�ĵ���̶ȴ�����ˮ��̶ȣ�����Һ�����ԣ�
��2��FeCl3��ˮ�⣬��������FeCl3ˮ�⣬ʵ��������FeCl3��Һʱ���轫FeCl3�ܽ��ڽ�Ũ�����У�Ȼ���ˮϡ�ͣ�
��3��Ka(HCN)= 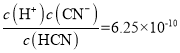 ��CN��+H2O
��CN��+H2O![]() HCN+OH������ 25��ʱ��ƽ�ⳣ��K=
HCN+OH������ 25��ʱ��ƽ�ⳣ��K= 1.6��10��5��
1.6��10��5��
��4����֪25�棬Kb(NH3��H2O)��1.8��10��5����NH4+��ˮ�ⳣ����![]() ��H2CO3��Ka1��4.2��10��7��Ka2��4.7��10��11����HCO3-��ˮ�ⳣ����
��H2CO3��Ka1��4.2��10��7��Ka2��4.7��10��11����HCO3-��ˮ�ⳣ����![]() ��HCO3-��ˮ��̶ȴ���NH4+��ˮ��̶ȣ�������Һ�ʼ��ԣ�pH��7��
��HCO3-��ˮ��̶ȴ���NH4+��ˮ��̶ȣ�������Һ�ʼ��ԣ�pH��7��
��5�����ݵ���غ㣬2c(SO42-)+ c(Cl-)+ c(OH-)= 2c(Mg2+)+ 3c(Fe3+)+ c(Na+)+ c(H+)��2a+0.58+ c(OH-)=2��0.05+3��0.1+0.5+ c(H+)������Һ����Fe3+��֪����Һ�����ԣ�c(OH-)��c(H+)������a��0.16��


 ��������ѧ����ϵ�д�
��������ѧ����ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ܱ������з�����ӦMg)N(g)����Ӧ�����е������仯��ͼ��������ʾ,����˵���������

A.�÷�Ӧ����Ӧ���ΪE3-E2
B.�÷�Ӧ����H=E1-E2
C.���ߢ��ʾ�����������䣬�����¶�ʱ�������仯
D.���ߢ��ʾ�����������䣬�������ʱ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��Ϊ![]() ���й�������ȷ���ǣ� ��
���й�������ȷ���ǣ� ��
A.̼��������Һ��![]()
B.̼������Һ��̼��������Һ��pHС
C.̼������Һ��![]()
D.̼������Һ�еμ�������pH=7��������Һ������ֻ��NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ��������ȷ����
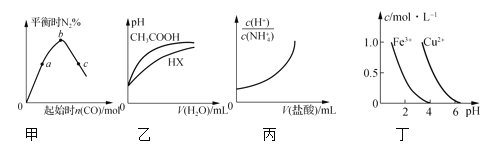
A.ͼ�ױ�ʾ��Ӧ4CO(g)��2NO2(g)![]() N2(g)��4CO2(g)�����������������䣬�ı�CO�����ʵ�����ƽ��ʱN2����������仯�������ͼ��֪��NO2��ת���ʣ�c��b��a
N2(g)��4CO2(g)�����������������䣬�ı�CO�����ʵ�����ƽ��ʱN2����������仯�������ͼ��֪��NO2��ת���ʣ�c��b��a
B.ͼ�ұ�ʾ25��ʱ���ֱ��ˮϡ�������Ϊ100 mL��pH��2��CH3COOH��Һ��HX��Һ����25��ʱHX�ĵ���ƽ�ⳣ������CH3COOH�ĵ���ƽ�ⳣ��
C.ͼ����ʾ25��ʱ����0.1 mol��L��1NH4Cl��Һ�еμ�0.1 mol��L��1���ᣬ��Һ����������ı仯��ϵ
D.����ͼ������Ҫ��ȥCuSO4��Һ�е�Fe3������Ҫ������Һ��pH��7����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵβ���к���NO����������ǿ��������������(Na2S2O8)�����ѳ�NO������������Ⱦ��
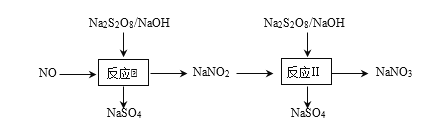
��1��NO3-�ռ乹��Ϊ__________��
��2��O��N��S����Ԫ�صĵ�һ��������С�����˳��Ϊ____________��
��3���ڷ�Ӧ2�У�NO2-�ij�ʼŨ��Ϊ0.1 mol��L��1����ӦΪNO2-��S2O82-��2OH��![]() NO3-��2SO42-��H2O����ͬ�¶��£��ﵽƽ��ʱNO2-���ѳ������������(Na2S2O8)��ʼŨ�ȵĹ�ϵ��ͼ1��ʾ��
NO3-��2SO42-��H2O����ͬ�¶��£��ﵽƽ��ʱNO2-���ѳ������������(Na2S2O8)��ʼŨ�ȵĹ�ϵ��ͼ1��ʾ��
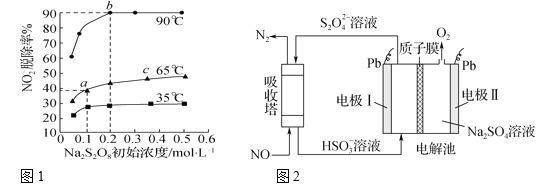
ͼ�е�a����b�͵�c��ƽ�ⳣ��K�Ĵ�С��ϵ____��
��4����ӵ绯ѧ���ɶԴ�����Ⱦ��NO���������������乤��ԭ����ͼ2��ʾ������Ĥ����H����H2Oͨ�����缫 �� �ĵ缫��ӦʽΪ____��ÿ����1 mol NO����ͬʱ�õ�____g O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N��S����Ҫ�ķǽ���Ԫ�أ��۵�����(SN)x����Ҫ�ij������ϣ�Ŀǰ����Ϊȫ�������ҵ�о����ȵ㡣�ش��������⣺
(1)���е����Ų�ͼ�ܱ�ʾ��ԭ�ӵ��������״̬����_____(����ĸ)��
A.![]() B.
B.![]()
C.![]() D.
D.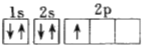
(2)Sԭ�ӵĻ�̬ԭ�Ӻ�����____��δ�ɶԵ��ӣ���__________�ֲ�ͬ��״�ĵ����ơ�
(3) S��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ________���о�һ����SCN-��Ϊ�ȵ�����ķ���Ϊ_______��
(4) (CH3)3N��Nԭ���ӻ���ʽΪ_______��As��N��ͬ����Ԫ�أ�AsH3����Է���������NH3��ʵ����AsH3�е��NH3�ͣ���ԭ����___________��
(5) GaN��һ����Ҫ�İ뵼����ϣ��侧���ṹ�ͽ��ʯ���ƣ��侧���ṹ��ͼ��
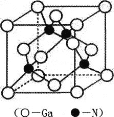
�ٵ������е�ԭ������ԭ��֮����_______�����ϣ���ͬһ��Gaԭ��������Nԭ�ӹ��ɵĿռ乹��Ϊ_______��
��GaN����ľ����߳�Ϊa pm��Ħ������ΪM g/mol�������ӵ�������ֵΪNA����GaN������ܶ�Ϊ_______gcm-3 (ֻҪ������ʽ�����ؼ���������1pm=l0-12m)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵��һ����ȷ����
A.25�棬12.0gNaHSO4�����к��е���������ĿΪ0.2NA
B.T��ʱ��1LpH=6�Ĵ�ˮ�У����е�OH����ĿΪ1��10��8NA
C.2.24LN2��NH3���������ԭ�Ӽ京�еĹ��õ��Ӷ���ĿΪ0.3NA
D.2molSO2��1molO2��һ�������³�ַ�Ӧ�����û������ķ���������2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʳ��ˮ�м���̼����刺��Ʊ�С�մ��˳�С�մ����ĸҺ��ͨ�백������ȴ����ʳ�Σ����ˣ��õ��Ȼ�粒��壮���з���������ǣ�������
A.���Ʊ�С�մ�ķ���ʽΪ��NaCl+NH4HCO3��NaHCO3��+NH4Cl
B.ĸҺ��ͨ��İ�����HCO3����Ӧ��NH3+HCO3����CO32��+NH4+
C.��ʳ����Ϊ������Һ��Cl����Ũ��
D.�����֪�¶Ƚϵ�ʱ���Ȼ�淋��ܽ�ȱ��Ȼ��ƵĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.������ѧ��Ӧʱʧȥ����Խ��Ľ���ԭ�ӣ���ԭ����Խǿ
B.���÷ǽ���������������ԭ��Ӧ��ֻ��������
C.������ֻ�������ԣ�������ֻ�л�ԭ��
D.����ijԪ�����̬�Ļ����ﲻһ������ǿ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com