
【题目】设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.25℃,12.0gNaHSO4固体中含有的阳离子数目为0.2NA
B.T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.2.24LN2和NH3混合气体中原子间含有的共用电子对数目为0.3NA
D.2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN-)__c(HCO3-)(填“>”、“<”或“=”)。
②常温下,物质的量浓度相同的三种溶液:A.CH3COONa;B.NaCN;C.Na2CO3,其pH由大到小的顺序是___(填编号)。
③将少量CO2通入NaCN溶液,反应的离子方程式是__。
④室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是__,溶液中![]() =__。(写出准确数值)
=__。(写出准确数值)
(2)某温度下,pH=3的盐酸中c(OH-)=10-9mol/L。该温度下,pH=2的H2SO4与pH=11的NaOH混合后pH变为9,则硫酸与氢氧化钠的体积比为__。
(3)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.l00mol/L的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
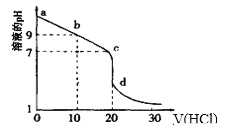
①d点所示的溶液中离子浓度由大到小的顺序依次为__。
②b点所示的溶液中c(NH4+)-c(NH3·H2O)=___。
(4)已知Ksp(BaSO4)=1.1×10-10,其溶解度为___g。(保留2位有效数字)
(5)室温下,已知Ksp(Fe(OH)3)=1×10-38,当Fe3+完全沉淀时,其溶液的pH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是
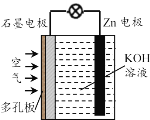
A.该电池放电时OH—向石墨电极移动
B.放电时氧气在石墨电极上发生还原反应
C.该电池在充电时Zn电极应与电源正极相连
D.该电池的负极反应为:Zn + H2O-2e—=ZnO + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀的溶解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.1 mol·L-1的NaHSO3溶液的pH约为4.0,请分析NaHSO3溶液显酸性的原因____。
(2)实验室配制FeCl3溶液时,需将FeCl3溶解在较浓盐酸中,然后加水稀释,这样操作的目的是____。
(3)KCN溶液中存在CN—+H2O![]() HCN+OH—,该反应在 25℃时的平衡常数K=____。(已知:25℃时,Ka(HCN)=6.25×10—10)
HCN+OH—,该反应在 25℃时的平衡常数K=____。(已知:25℃时,Ka(HCN)=6.25×10—10)
(4)已知25℃,Kb(NH3·H2O)=1.8×10-5,H2CO3的Ka1=4.2×10-7、Ka2=4.7×10-11。则NH4HCO3溶液的pH____(填“>、<或=”)7。
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表所示(H+和OH—未列出)
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl— |
浓度/mol·L-1 | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a____0.16(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。
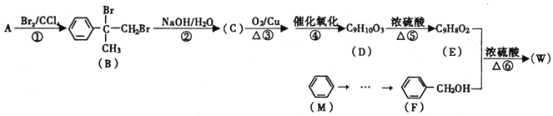
请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
(1)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为___。如果反应中有5mol电子发生转移,可得到___ g肼。
(2)常温下向25mL0.01mol/L稀盐酸中缓缓通入5.6mLNH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是___。在通入NH3的过程中溶液的导电能力___(填写“变大”、“变小”或“几乎不变”)。
(3)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是___(选填编号)。
a.[Cl-]=[NH4+]>[H+]=[OH-] b.[Cl-]>[NH4+]=[H+]>[OH-
c.[NH4+]>[OH-]>[Cl-]>[H+] d.[OH-]>[NH4+]>[H+]>[Cl-]
(4)常温下向25mL含HCl0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡(填写电离平衡移动情况)___。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。字母代表元素,分析正确的是
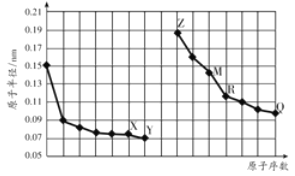
A. R在周期表的第15列
B. Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
C. 简单离子的半径:X>Z>M
D. Z的单质能从M与Q元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与下列事实对应的化学用语错误是( )
A.纯碱溶液能清洗油污:CO32﹣+H2OHCO3﹣+OH﹣
B.配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+
C.含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH﹣+CO32﹣+3H+→HCO3﹣+2H2O
D.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42﹣恰好沉淀完全:2Ba2++4OH﹣+Al3++2SO42﹣→2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A. B.
B.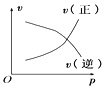 C.
C.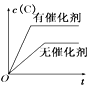 D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com