
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。
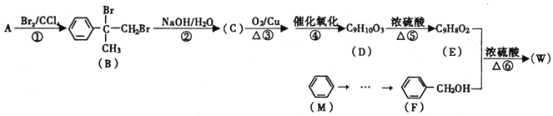
请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
【答案】苯甲醇 消去反应 碳碳双键、羧基 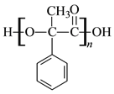
 否 在醛基被催化氧化的同时,碳碳双键也被能氧化 5
否 在醛基被催化氧化的同时,碳碳双键也被能氧化 5 ![]()
![]()
【解析】
由B的结构可知A为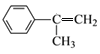 ,A与溴发生加成反应生成B,B发生水解反应生成C为
,A与溴发生加成反应生成B,B发生水解反应生成C为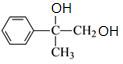 ,C催化氧化的产物继续氧化生成D,则D为
,C催化氧化的产物继续氧化生成D,则D为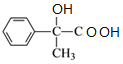 ,对比D、E分子式可知D分子内脱去1分子水生成E,故D在浓硫酸、加热条件下发生消去反应生成E,则E为
,对比D、E分子式可知D分子内脱去1分子水生成E,故D在浓硫酸、加热条件下发生消去反应生成E,则E为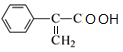 ,E和F发生酯化反应生成W为
,E和F发生酯化反应生成W为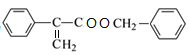 。
。
(1)F的结构简式为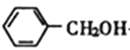 ,的化学名称是苯甲醇,⑤为D在浓硫酸、加热条件下发生消去反应生成E。
,的化学名称是苯甲醇,⑤为D在浓硫酸、加热条件下发生消去反应生成E。
(2)E的结构为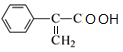 ,含有的官能团是碳碳双键、羧基,D
,含有的官能团是碳碳双键、羧基,D 含有羧基和羟基,能发生聚合生成酯类高分子化合物,结构简式为
含有羧基和羟基,能发生聚合生成酯类高分子化合物,结构简式为 。
。
(3) 经过反应③,是羟基连接的碳原子上有2个氢原子的碳原子发生氧化反应生成醛基得到
经过反应③,是羟基连接的碳原子上有2个氢原子的碳原子发生氧化反应生成醛基得到![]() ,与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式
,与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式 。
。
(4)④、⑤两步不能颠倒,因为在醛基被催化氧化的同时,碳碳双键也被能氧化。
(5)与A 具有含有相同官能团的芳香化合物的同分异构体还有5种。苯环上可以连接一个甲基和一个-CH=CH2,有三种结构,也可以是苯环上连接-CH=CHCH3或-CH2CH=CH2,共5种,其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为
具有含有相同官能团的芳香化合物的同分异构体还有5种。苯环上可以连接一个甲基和一个-CH=CH2,有三种结构,也可以是苯环上连接-CH=CHCH3或-CH2CH=CH2,共5种,其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为![]() 。
。
(6)根据逆推原理分析,合成苯甲醇,需要制备![]() ,可以用甲苯的取代反应,利用苯和一氯甲烷发生取代反应生成甲苯,故合成路线为:
,可以用甲苯的取代反应,利用苯和一氯甲烷发生取代反应生成甲苯,故合成路线为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反应进行的方向和限度的说法中正确的是( )
A.mA(s)+nB(g)![]() pC(g),平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动
pC(g),平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动
B.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),则CO2的体积分数不变可以作为平衡判断的依据
2NH3(g)+CO2(g),则CO2的体积分数不变可以作为平衡判断的依据
C.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
D.对于反应A(g)+B(g)![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
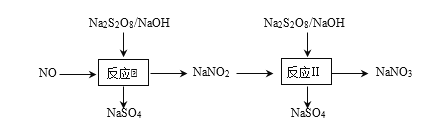
【题目】硝酸工业尾气中含有NO,可以利用强氧化剂过硫酸钠(Na2S2O8)氧化脱除NO,可以消除污染。
(1)NO3-空间构型为__________。
(2)O、N、S三种元素的第一电离能由小到大的顺序为____________。
(3)在反应2中,NO2-的初始浓度为0.1 mol·L-1,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图1所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图1所示。
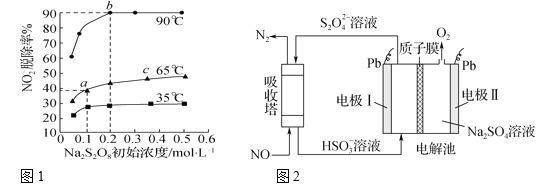
图中点a、点b和点c的平衡常数K的大小关系____。
(4)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图2所示,质子膜允许H+和H2O通过。电极 Ⅰ 的电极反应式为____,每处理1 mol NO,可同时得到____g O2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molN2O4放入2L恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:
2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:

(1)D点v(正)____v(逆)(填“>、<或=”)。
(2)A、B、C三点中平衡常数K的值最大的是____点。T2时N2O4的平衡转化率为____;若平衡时间为5s,则此时间内的N2O4平均反应速率为____。
(3)若其条件不变,在T3原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数____(填“增大、不变或减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.25℃,12.0gNaHSO4固体中含有的阳离子数目为0.2NA
B.T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.2.24LN2和NH3混合气体中原子间含有的共用电子对数目为0.3NA
D.2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) ![]() CH3COOH(g)△H<0。下列说法正确的是
CH3COOH(g)△H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛元素在周期表中的相对位置如图所示。甲和戊的原子序数相差3,戊的一种单质是自然界中硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )
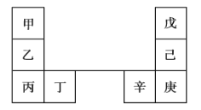
A.金属性:甲![]() 乙
乙![]() 丁
丁
B.原子半径:庚![]() 己
己![]() 戊
戊
C.丙和庚的原子核外电子数相差12
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
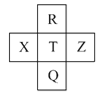
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com