
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) ![]() CH3COOH(g)△H<0。下列说法正确的是
CH3COOH(g)△H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1
【答案】BD
【解析】分析:根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但温度不同;容器II中的起始量为相同条件容器I中的1.2倍,再结合等效平衡和平衡的移动判断两容器中气体的物质的量之间的关系。
CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但温度不同;容器II中的起始量为相同条件容器I中的1.2倍,再结合等效平衡和平衡的移动判断两容器中气体的物质的量之间的关系。
详解:A.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,容器I中平衡时浓度之和为0.4+0.1+0.1=0.6 mol/L,因此达平衡时,容器II中平衡时浓度之和小于0.6 mol/L×1.2=0.72 mol/L,容器I与容器II中的总压强之比大于0.6:0.72=5:6>3:4,故A错误;B.根据CH3OH(g)+CO(g)
CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,容器I中平衡时浓度之和为0.4+0.1+0.1=0.6 mol/L,因此达平衡时,容器II中平衡时浓度之和小于0.6 mol/L×1.2=0.72 mol/L,容器I与容器II中的总压强之比大于0.6:0.72=5:6>3:4,故A错误;B.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,则
CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,则![]() 增大,故B正确;C.根据CH3OH(g)+CO(g)
增大,故B正确;C.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但容器Ⅲ中的温度低,温度越低,反应速率越慢,因此达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故C错误;D. 根据CH3OH(g)+CO(g)
CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但容器Ⅲ中的温度低,温度越低,反应速率越慢,因此达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故C错误;D. 根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效;该反应为放热反应,降低温度,平衡正向移动,CH3COOH的转化率减小,因此达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1,故D正确;故选BD。
CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效;该反应为放热反应,降低温度,平衡正向移动,CH3COOH的转化率减小,因此达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1,故D正确;故选BD。


科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A. 向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B. 向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有SO![]()
C. 向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D. 向某溶液中加入氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,说明原溶液中有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列关于有机物的问题:
(1)下列有机物属于酯类的是_________(填正确答案编号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.CH3CH2OH
D.CH3CH2OH
(2)下列有机物不能发生水解反应的是__________(填正确答案编号)
A.油脂 B.葡萄糖 C.纤维素 D.蛋白质
(3)下列有机物属于芳香族化合物的是____(填正确答案编号,下同),与环己烷互为同系物的是_____,能使溴的四氯化碳溶液褪色的是___________;D和H2反应的化学方程式是____________。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测站经常测定水中溶解氧的情况,主要步骤是量取100mL水样,迅速加入固定剂MnSO4和碱性KI(含KOH)溶液,完全反应后加入硫酸使之生成I2,再用0.0040mol/L的Na2S2O3溶液与之反应。有关反应的化学方程式为:
①2MnSO4+O2+4KOH=2MnO(OH)2+2K2SO4(该反应极快)
②MnO(OH)2+2KI+2H2SO4=MnSO4+I2+K2SO4+3H2O
③I2+2Na2S2O3=2NaI+Na2S4O6
(1)若该水样消耗20.00mLNa2S2O3溶液,所耗Na2S2O3的物质的量为________mol。
(2)试计算该水样中的溶解氧_____(g/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰氧基胡椒酚乙酸酯(F)具有抗氧化性、抗肿瘤作用,其合成路线如下:
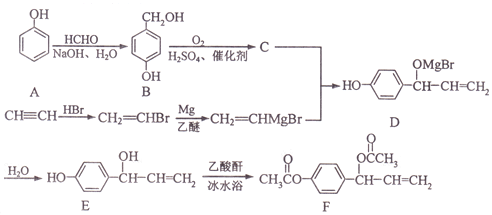
已知:RMgBr![]()
(1)化合物F中含氧官能团的名称为______。
(2)A-B的反应类型为_______。
(3)化合物C的结构简式为______。
(4)1mol化合物E与足量乙酸酐[(CH3CO)2O]反应,除F外另一产物的物质的量为_______。
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱显示有4种不同化学环境的氢,其峰面积比为6:2:1:1。
(6)请以甲苯和乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】起始时向密闭容器中充入amolNO2(g),反应 2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通bmolNO2(g),又达到平衡时,下列说法中不正确的是( )
N2O4(g)达到平衡后,再向容器内通bmolNO2(g),又达到平衡时,下列说法中不正确的是( )
A. 恒温恒压和恒温恒容条件下,NO2 的物质的量都增大
B. 恒温恒压和恒温恒容条件下,NO2 的物质的量浓度都增大
C. 恒温恒压和恒温恒容条件下,NO2 转化率前者不变,后者增大
D. 恒温恒压和恒温恒容条件下,混合气体的平均摩尔质量前者不变,后者增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过简单的计算完成下列问题:
(1)已知:常温下HF的Ka=1×10-4,NH3H2O的Kb=1×10-5,则NH4F溶液显_______性,保存此溶液应该放在_______中。
(2)已知:常温下 H2S的Ka1=1×10-7、Ka2=1×10-15,CuS的Ksp=1×10-36,FeS的Ksp=1×10-17,则:
①反应CuS(s)+2HCl(aq)![]() H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)
H2S(aq)+CuCl2(aq)的K=__________;反应FeS(s)+2HCl(aq)![]() H2S(aq)+FeCl2(aq)的 K=_____;
H2S(aq)+FeCl2(aq)的 K=_____;
由计算结果我们可以知道CuS和FeS中________可溶于盐酸。
②反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
FeS(s)+Cu2+(aq)的K=_____;除去废水中的 Cu2+使用过量的FeS固体的优点有:a.可以除去废水中的Cu2+,过量的FeS和生成的CuS可以通过过滤一并除去;b. _________________________________。
(3)已知:常温下 Fe(OH)3的 Ksp=1×10-38,则 Fe3+沉淀完全的pH=______;配置FeCl3溶液的方法是______。(以浓度≤10-5mol/L为沉淀完全)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com