
【题目】环境监测站经常测定水中溶解氧的情况,主要步骤是量取100mL水样,迅速加入固定剂MnSO4和碱性KI(含KOH)溶液,完全反应后加入硫酸使之生成I2,再用0.0040mol/L的Na2S2O3溶液与之反应。有关反应的化学方程式为:
①2MnSO4+O2+4KOH=2MnO(OH)2+2K2SO4(该反应极快)
②MnO(OH)2+2KI+2H2SO4=MnSO4+I2+K2SO4+3H2O
③I2+2Na2S2O3=2NaI+Na2S4O6
(1)若该水样消耗20.00mLNa2S2O3溶液,所耗Na2S2O3的物质的量为________mol。
(2)试计算该水样中的溶解氧_____(g/L)。
科目:高中化学 来源: 题型:
【题目】一定条件下,A、B、C的起始浓度分别是0.5mol/L、0.1 mol/L、1.6mol/L,可逆反应A(g)+B(g)![]() 2C(g)达到平衡时,下列数据合理的是
2C(g)达到平衡时,下列数据合理的是
A. c(A)=1.0mol/L c(B)=0.2mol/L B. c(B)=0.5mol/L c(C)=1.2mol/L
C. c(A)=0.4mol/L c(C)=1.8mol/L D. c(A )=0.9mol/L c(B)=0.5mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是( )
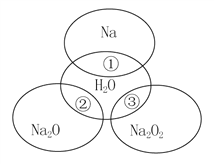
A. Na2O2中阴阳离子数目之比为1∶1
B. 反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑
C. ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
D. 反应③转移电子的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:
CH3OH(g)+CO(g) ![]() CH3COOH(g)△H<0。下列说法正确的是
CH3COOH(g)△H<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器I与容器II中的总压强之比为3:4
B. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
C. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
D. 达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
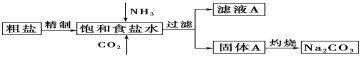
【题目】纯碱(Na2CO3)在生产生活中具有广泛的用途。
Ⅰ.以下是实验室模拟制碱原理制取Na2CO3的流程图。
下表是四种物质在100g水中不同温度的溶解度

(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。精制除杂的步骤顺序是a→________→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣 b.加入盐酸调pH c.加入Ba(OH)2溶液
d.加入Na2CO3溶液 e.过滤
(2)向饱和食盐水中先通入_______,后通入________,生成固体A的化学方程式为____
Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把6g样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干后得到5g固体。
(3)洗涤沉淀的具体操作是_____________________________。
(4)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为___________(结果保留小数点后一位)。
方案二:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
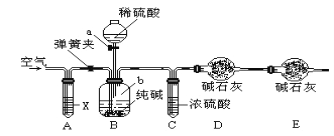
已知:碱石灰为氢氧化钠和氧化钙的混合物。
(5)实验开始前应进行的操作是______________________________。
(6)仪器a的名称为___________________,装置A中试剂X应选用_________________。
(7)装置E的作用是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下 0.1mol/L 氨水pH为11,则下列说法中不正确的是( )
A. 此溶液中 NH3H2O 在常温下的电离度约为1%
B. 若向此溶液中通入少量氨气,NH3H2O电离平衡正向移动,水的电离平衡逆向移动
C. 若向其中加入 pH为11的NaOH溶液,NH3H2O电离平衡不移动,但n(NH4+)减小
D. 若向其中加入少量水,溶液中n(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3k/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
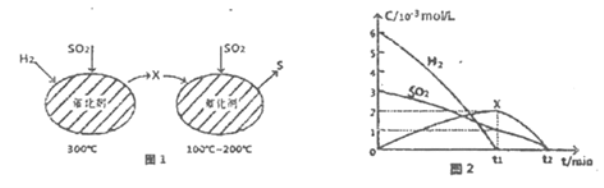
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SOz表示的化学反应速率为________。
②总反应的化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的△H____0(填“>”或“<”)
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com