
ЁОЬтФПЁПSO2ЕФКЌСПЪЧКтзюДѓЦјЮлШОЕФвЛИіживЊжИБъЃЌЙЄвЕЩЯГЃВЩгУДпЛЏЛЙдЗЈЛђЮќЪеЗЈДІРэSO2ЁЃРћгУДпЛЏЛЙдSO2ВЛНіПЩЯћГ§SO2ЮлШОЃЌЖјЧвПЩЕУЕНгаОМУМлжЕЕФЕЅжЪSЁЃ
ЃЈ1ЃЉдкИДКЯзщЗжДпЛЏМСзїгУЯТЃЌCH4ПЩЪЙSO2зЊЛЏЮЊSЃЌЭЌЪБЩњГЩCO2КЭH2OЁЃ
МКжЊCH4КЭSЕФШМЩеШШ(ЁїH)ЗжБ№ЮЊ-890.3k/molКЭ-297.2kJ/molЃЌдђCH4КЭSO2ЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ_____________ЁЃ
ЃЈ2ЃЉгУH2ЛЙдSO2ЩњГЩSЕФЗДгІЗжСНВНЭъГЩЃЌШчЭМ1ЫљЪОЃЌИУЙ§ГЬжаЯрЙиЮяжЪЕФЮяжЪЕФСПХЈЖШЫцЪБМфЕФБфЛЏЙиЯЕШчЭМ2ЫљЪО:
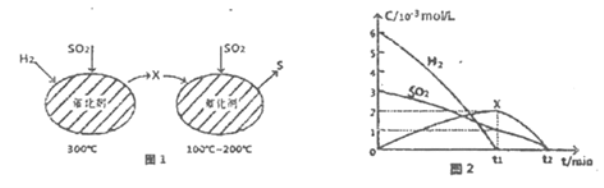
ЂйЗжЮіПЩжЊXЮЊ______(аДЛЏбЇЪН)ЃЌ0ЁЋt1ЪБМфЖЮЕФЮТЖШЮЊ_____ЃЌ0ЁЋt1ЪБМфЖЮгУSOzБэЪОЕФЛЏбЇЗДгІЫйТЪЮЊ________ЁЃ
ЂкзмЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________ЁЃ
ЃЈ3ЃЉНЙЬПДпЛЏЛЙдSO2ЩњГЩS2,ЛЏбЇЗНГЬЪНЮЊ:2C(s)+2SO2(g)![]() S2(g)+2CO2(g)ЃЌКуШнШнЦїжаЃЌ1mol/LSO2гызуСПЕФНЙЬПЗДгІЃЌSO2ЕФзЊЛЏТЪЫцЮТЖШЕФБфЛЏШчЭМ3ЫљЪОЁЃ
S2(g)+2CO2(g)ЃЌКуШнШнЦїжаЃЌ1mol/LSO2гызуСПЕФНЙЬПЗДгІЃЌSO2ЕФзЊЛЏТЪЫцЮТЖШЕФБфЛЏШчЭМ3ЫљЪОЁЃ

ЂйИУЗДгІЕФЁїH____0(ЬюЁА>ЁБЛђЁА<ЁБ)
ЂкЫуaЕуЕФЦНКтГЃЪ§ЮЊ_________ЁЃ
ЃЈ4ЃЉЙЄвЕЩЯПЩгУNa2SO3ШмвКЮќЪеЗЈДІРэSO2,25ЁцЪБгУ1mo/LЕФNa2SO3ШмвКЮќЪеSO2ЁЃЕБШмвКpH=7ЪБЃЌШмвКжаИїРызгХЈЖШЕФДѓаЁЙиЯЕЮЊ________ЁЃвбжЊ:H2SO3ЕФЕчРыГЃЪ§K1=1.3ЁС10-2ЃЌK2=6.2ЁС10-8
ЁОД№АИЁП CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ЁїH=-295.9kJ/mol H2S 300Ёц 2ЁС10-3/t1mol/(LЁЄmin) 2H2+SO2![]() S+2H2O < 36.45mol/L c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
S+2H2O < 36.45mol/L c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
ЁОНтЮіЁП(1)CH4КЭSЕФШМЩеШШЗжБ№ЮЊ890.3kJ/molКЭ297.2kJ/molЃЌПЩжЊШШЛЏбЇЗНГЬЪНЃКЂйCH4(g)+2O2(g)ЈTCO2(g)+2H2O(l)ЁїH=-890.3kJ/molЃЌЂкS(s)+O2(g)ЈTSO2(g)ЁїH=-297.2kJ/molЃЌИљОнИЧЫЙЖЈТЩЃЌНЋЂй-ЂкЁС2ПЩЕУCH4(g)+2SO2(g)ЈTCO2(g)+2S(s)+2H2O(l)ЁїH=-295.9kJ/molЃЌЙЪД№АИЮЊЃКCH4(g)+2SO2(g)ЈTCO2(g)+2S(s)+2H2O(l)ЁїH=-295.9kJ/molЃЛ
(2)ЂйИљОнЭМ1ПЩжЊЃЌдк300ЁцЪБЃЌSO2КЭH2ЗДгІЩњГЩH2SЃЌдк100ЁцЕН200ЁцЪБЃЌH2SКЭSO2ЗДгІЩњГЩSКЭЫЎЃЌЙЪXЮЊH2SЃЛдкЭМ2жаЃЌ0ЁЋt1ЪБМфЖЮSO2КЭH2ЕФХЈЖШНЕЕЭЃЌH2SЕФХЈЖШЩ§ИпЃЌЙЪ0ЁЋt1ЪБМфЖЮЮТЖШЮЊ300ЁцЃЛгУSO2БэЪОЕФЛЏбЇЗДгІЫйТЪv=![]() =
=![]() =
=![]() ЁС103 mol/(LЁЄ min)ЃЌЙЪД№АИЮЊЃКH2SЃЛ300ЁцЃЛ
ЁС103 mol/(LЁЄ min)ЃЌЙЪД№АИЮЊЃКH2SЃЛ300ЁцЃЛ![]() ЁС103 mol/(LЁЄ min)ЃЛ
ЁС103 mol/(LЁЄ min)ЃЛ
ЂкИљОнЗжЮіПЩжЊЃЌSO2КЭH2зюжеЗДгІЩњГЩSКЭЫЎЃЌЙЪЛЏбЇЗНГЬЪНЮЊ2H2+SO2ЈTS+2H2OЃЌЙЪД№АИЮЊЃК2H2+SO2ЈTS+2H2OЃЛ
(3)ЂйИљОнЭМЯёПЩжЊЃЌЩ§ИпЮТЖШЃЌSO2ЕФзЊЛЏТЪНЕЕЭЃЌМДЦНКтзѓвЦЃЌДЫЗДгІЮЊЗХШШЗДгІЃЌМДЁїHЃМ0ЃЌЙЪД№АИЮЊЃКЃМЃЛ
ЂкгЩгкЕуaЕФЖўбѕЛЏСђЕФзЊЛЏТЪЮЊ90%ЃЌЙЪгаЃК
2C(s)+2SO2(g)S2(g)+2CO2(g)
ГѕЪМ(c)ЃК 1mol/L 0 0
зЊЛЏ(c)ЃК 0.9mol/L0.45mol/L0.9mol/L
ЦНКт(c)ЃК 0.1mol/L 0.45mol/L 0.9mol/L
ЙЪЦНКтГЃЪ§K=![]() =
=![]() =36.45ЃЌЙЪД№АИЮЊЃК36.45ЃЛ
=36.45ЃЌЙЪД№АИЮЊЃК36.45ЃЛ
(4)Na2SO3ШмвКЮќЪеSO2ЩњГЩNaHSO3ЃЌРызгЗНГЬЪНЮЊSO32-+SO2+H2OЈT2HSO3-ЃЛ25ЁцЪБгУ1mol/LЕФNa2SO3ШмвКЮќЪеSO2ЃЌЕБШмвКpH=7ЪБЃЌШмвКжаЕФШмжЪЮЊNa2![]() ПЩжЊ
ПЩжЊ![]() =0.62ЃЌЙЪc(HSO3-)ЃОc(SO32-)ЃЌдђгаЃКc(Na+)ЃОc(HSO3-)ЃОc(SO32-)ЃОc(H+)=c(OH-)ЃЌЙЪД№АИЮЊЃКc(Na+)ЃОc(HSO3-)ЃОc(SO32-)ЃОc(H+)=c(OH-)ЁЃ
=0.62ЃЌЙЪc(HSO3-)ЃОc(SO32-)ЃЌдђгаЃКc(Na+)ЃОc(HSO3-)ЃОc(SO32-)ЃОc(H+)=c(OH-)ЃЌЙЪД№АИЮЊЃКc(Na+)ЃОc(HSO3-)ЃОc(SO32-)ЃОc(H+)=c(OH-)ЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25 ЁцЪБЃЌФГШмвКжагЩЫЎЕчРыВњЩњЕФc(HЃЋ)КЭc(OHЃ)ЕФГЫЛ§ЮЊ1ЁС10Ѓ18ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. ДЫШмвКВЛДцдк B. ИУШмвКЕФpHПЩФмЪЧ5
C. ИУШмвКЕФpHвЛЖЈЪЧ7 D. ИУШмвКвЛЖЈЪЧpHЃН9
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПTЁцЪБЃЌдкШнЛ§ЮЊ0.5LЕФУмБеШнЦїжаЗЂЩњФГвЛЗДгІЃЌЧвВтЕУВЛЭЌЪБМфШнЦїжаЫФжжЮяжЪAЁЂBЁЂCЁЂDЕФЮяжЪЕФСПБфЛЏШчЭМЫљЪОЃЌвбжЊЃКЮяжЪAЁЂBЁЂCОљЮЊЦјЬЌЃЌDЮЊЙЬЬЌЃЌе§ЗДгІЪБЮќШШЗДгІЃЌИљОнвЊЧѓЛиД№ЯТСаЮЪЬтЃК 
ЃЈ1ЃЉШнЦїжаЗДгІЕФЛЏбЇЗНГЬЪНЮЊ
ЃЈ2ЃЉЧА2 minЃЌvЃЈAЃЉ=molЃЈminLЃЉЉ1 ЃЎ
ЃЈ3ЃЉФмЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧЁЁ ЁЁ ЃЎ
A.ЛьКЯЦјЬхЕФбЙЧПВЛБф
B.ЛьКЯЦјЬхЕФУмЖШВЛБф
C.ЯћКФ0.1molЕФBЭЌЪБЩњГЩ0.1molЕФD
D.BЕФЮяжЪЕФСПВЛБф
ЃЈ4ЃЉTЁцЪБЃЌИУЗДгІЕФЦНКтГЃЪ§K=ЃЈБЃСєаЁЪ§ЕуКѓСНЮЛЃЉЃЎ
ЃЈ5ЃЉЗДгІДяЕНЦНКтКѓЃЌИФБфЯТСаДыЪЉФмЪЙAЕФзЊЛЏТЪдіДѓЕФЪЧЁЁ ЁЁЃЈЬюбЁЯюзжФИЃЉЃЎ
A.жЛдіМгAЕФЮяжЪЕФСП
B.вЦзпвЛВПЗжD
C.Щ§ИпЗДгІЬхЯЕЕФЮТЖШ
D.АбШнЦїЕФЬхЛ§ЫѕаЁвЛБЖ
ЃЈ6ЃЉTЁцЪБЃЌШнЛ§ЮЊ1 LЕФУмБеШнЦїжаЃЌЦ№ЪМЪБГфШы0.2 mol AЁЂ0.4 mol BЁЂ0.3 mol CЁЂ0.5 mol DЃЌДЫЪБvЃЈе§ЃЉvЃЈФцЃЉЃЈЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБЃЉЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙигаЛњЮяЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. C2H5COOC2H5ДцдкC4H9COOHЪБПЩвдМгШыБЅКЭNa2CO3ШмвККѓЗжвКГ§ШЅ
B. C3H7COOCH3(m)ЁЂC2H5COOC2H5(e)ЁЂC4H9COOH(p)ЕФЗжзгЪНОљЮЊC5H10O2ЃЌЧвТњзуm ЕФЭЌЗжвьЙЙЬхБШp ЕФЖр
C. ЗжзгЪНЮЊC5H12OЧвФмгыН№ЪєФЦЗДгІВњЩњЦјЬхЕФгаЛњЮяЃЌЦфЭЌЗжвьЙЙЬхЙВга9жж
D. 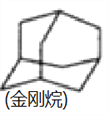 КЌгаЪєгкЗМЯуЛЏКЯЮяЕФЭЌЗжвьЙЙЬх
КЌгаЪєгкЗМЯуЛЏКЯЮяЕФЭЌЗжвьЙЙЬх
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЗМЯуЬўAгаШчЭМзЊЛЏЙиЯЕЃК 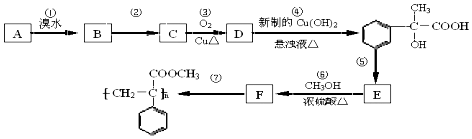
ЃЈ1ЃЉаДГіЗДгІЂкКЭЂнЕФЗДгІЬѕМўЃКЂкЃЛЂн ЃЎ
ЃЈ2ЃЉаДГіAКЭDНсЙЙМђЪНЃКAЃЛD
ЃЈ3ЃЉаДГіЗДгІЂоЕФЛЏбЇЗНГЬЪНЃК ЃЎ
ЃЈ4ЃЉЗДгІЂлЕФЗДгІРраЭ ЃЎ
ЃЈ5ЃЉИљОнвббЇжЊЪЖКЭЛёШЁЕФаХЯЂЃЌаДГівдCH3COOHЃЌ ![]() ЮЊдСЯКЯГЩживЊЕФЛЏЙЄВњЦЗ
ЮЊдСЯКЯГЩживЊЕФЛЏЙЄВњЦЗ ![]() ЕФТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮбЁЃЉ КЯГЩТЗЯпСїГЬЭМЪОР§ШчЯТЃКCH3CH2OH
ЕФТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮбЁЃЉ КЯГЩТЗЯпСїГЬЭМЪОР§ШчЯТЃКCH3CH2OH ![]() H2C=CH2
H2C=CH2 ![]()
![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЬѕМўвЛЖЈФмЪЙЗДгІЫйТЪМгПьЕФЪЧЃЈ ЃЉ
ЂйдіМгЗДгІЮяЕФЮяжЪЕФСПЂкЩ§ИпЮТЖШЂлЫѕаЁЗДгІШнЦїЕФЬхЛ§ЂмМгШыЩњГЩЮяЂнМгШыMnO2
A.ШЋВПB.ЂйЂкЂнC.ЂкЂлD.Ђк
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбЧЯѕѕЃТШ(ClNO)ГЃгУзїДпЛЏМСКЭКЯГЩЯДЕгМСЃЌЦфЗаЕуЮЊ-5.5ЁцЃЌвзЫЎНтЩњГЩHNO2КЭHClЁЃФГбЇЯАаЁзщдкЪЕбщЪвжагУЯТЭМЫљЪОзАжУжЦБИClNOЁЃвбжЊ: HNO2МШгабѕЛЏадгжгаЛЙдадЃЛAgNO2ЮЂШмгкЫЎЃЌФмШмгкЯѕЫсЃЌAgNO2+HNO3=AgNO3+HNO2ЁЃ

ЛиД№ЯТСаЮЪЬт
ЃЈ1ЃЉвЧЦїaЕФУћГЦЮЊ_____________ЃЌ aдкзАжУCжаЕФзїгУЪЧ____________ЁЃ
ЃЈ2ЃЉзАжУBЕФзїгУЪЧ____________ЁЃ
ЃЈ3ЃЉЪЕбщПЊЪМЪБЃЌЯШДђПЊK1ЁЂK2ЃЌЙиБеK3ЃЌдйДђПЊЗжвКТЉЖЗЛюШћЕЮШыЪЪСПЯЁЯѕЫсЃЌЕБЙлВьЕНCжа______ЪБЙиБеK1ЁЂK2ЁЃЯђзАжУDШ§ОБЦПжаЭЈШыИЩдяДПОЛCl2ЃЌЕБЦПжаГфТњЛЦТЬЩЋЦјЬхЪБЃЌдйДђПЊK1ЁЂK3ЃЌжЦБИClNOЁЃ
ЃЈ4ЃЉзАжУDжаИЩдяЙмЕФзїгУЪЧ__________________ЁЃ
ЃЈ5ЃЉЪЕбщЙ§ГЬжаЃЌШєбЇЯАаЁзщЭЌбЇгУОЦОЋЕЦДѓЛ№МгШШжЦШЁNOЃЌЖдБОЪЕбщдьГЩЕФВЛРћгАЯьГ§СЫгаЗДгІЫйТЪЙ§ПьЃЌЪЙNOРДВЛМАЗДгІМДДѓСПвнГіЭтЃЌЛЙПЩФмгаЃК___________ЁЃ
ЃЈ6ЃЉЂйвЊбщжЄClNOгыH2OЗДгІКѓЕФШмвКжаДцдкCl-КЭHNO2ЃЌКЯРэЕФВйзїВНжшМАе§ШЗЕФЫГађЪЧ_____(ЬюађКХ)ЁЃ
a.ЯђЩеБжаЕЮМгЙ§СПKIЕэЗлШмвКЃЌШмвКБфРЖЩЋ
b.ШЁ1.0mL Ш§ОБЦПжаВњЦЗгкЩеБжаЃЌМгШы10.0mLH2OГфЗжЗДгІ
c.ЯђЩеБжаЕЮМгЫсадKMnO4ШмвКЃЌШмвКзЯЩЋЭЪШЅ
d.ЯђЩеБжаЕЮМгзуСПAgNO3ШмвКЃЌгаАзЩЋГСЕэЩњГЩЃЌМгШыЯЁЯѕЫсЃЌНСАшЃЌШдгаАзЩЋГСЕэ
ЂкХфжЦЭѕЫЎЕФЙ§ГЬжаЛсЗДгІВњЩњClNOЃЌЧыаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃК__________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌдкШнЛ§КуЖЈЕФУмБеШнЦїжаНјааЗДгІA(s)ЃЋ2B(g)![]() C(g)ЃЋD(g)ЃЌЯТСаа№ЪіФмБэУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ( )
C(g)ЃЋD(g)ЃЌЯТСаа№ЪіФмБэУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ( )
ЂйЛьКЯЦјЬхЕФУмЖШВЛБф
ЂкШнЦїФкЦјЬхЕФбЙЧПВЛБф
ЂлЛьКЯЦјЬхЕФзмЮяжЪЕФСПВЛБф
ЂмBЕФЮяжЪЕФСПХЈЖШВЛБф
Ђнvе§(C)ЃНvФц(D)
Ђоvе§(B)ЃН2vФц(C)
A. ЂйЂмЂнЂо B. ЂкЂлЂо C. ЂкЂмЂнЂо D. жЛгаЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2molFeCl2гы1molCl2ЧЁКУЭъШЋЗДгІЃЌдђВњЮяЕФЮяжЪЕФСПЮЊ
AЃЎ1mol BЃЎ2mol CЃЎ3mol DЃЎ4mol
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com