
【题目】2molFeCl2与1molCl2恰好完全反应,则产物的物质的量为
A.1mol B.2mol C.3mol D.4mol
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3k/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
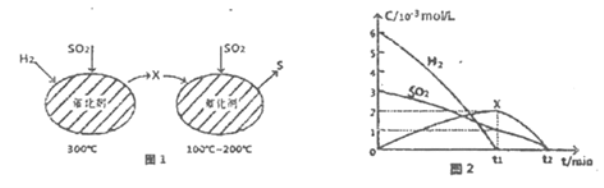
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SOz表示的化学反应速率为________。
②总反应的化学方程式为_____________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的△H____0(填“>”或“<”)
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取三张蓝色石蕊试纸用蒸馏水润湿后贴在玻璃片上,然后按顺序分别滴加足量的浓硝酸、浓硫酸和浓盐酸,三张纸最终变成( )
A.白色、红色、红色
B.红色、红色、红色
C.红色、黑色、白色
D.白色、黑色、红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将下列物质溶于水中分别配制成0.1 molL—1溶液,所得溶液pH大于7的是
A. NaCl B. HCl C. NaOH D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A,C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A,B,C,D依次是( )
A.Fe、Cu、Al、Ag
B.Al、Cu、Fe、Ag
C.Cu、Ag、Al、Fe
D.Ag、Al、Cu、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2) 与NH3相似,水溶液呈碱性,25℃时,向10mL0.1mol·L-1乙二胺溶液中滴加0.1 mol·L-1盐酸,各组分的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是

A. 混合溶液呈中性时,滴加盐酸的体积小于10mL
B. Kb2[H2NCH2CH2NH2] 的数量级为10-8
C. a 点所处的溶液中:c(H+)+3c([H3NCH2CH2NH3]2+)=c(OH-) +(Cl-)
D. 水的电离程度:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度时,用惰性电极电解硝酸钠的不饱和溶液.若两极板收集到气体总体积为22.4aL时,剩余溶液恢复至原温度,析出溶质mg(溶质不带结晶水);若两极收集到气体总体积为33.6aL时,剩余溶液恢复至原温度,析出溶质ng.则硝酸钠在该温度时的溶解度是(气体体积均已折合为标准状况下的体积)( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。
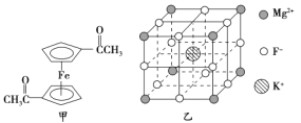
【答案】 1s22s22p63s23p63d5(或3d5) sp3、sp2 N>O>C CO(或N2) 4∶3 KMgF3
【解析】(1)Fe的原子序数为26,Fe3+的基态核外电子排布式为1s22s22p63s23p63d5(或3d5)。
(2)根据图中乙酰基二茂铁的结构可知,碳原子的杂化方式有两种。其中形成碳氧双键的碳原子和五元环上的碳原子杂化方式是sp2杂化,而-CH3上的碳原子杂化方式是sp3杂化。
(3)根据元素周期律,可知同周期元素原子第一电离能随着原子序数的增加逐渐增大,由于原子轨道上电子处于全满、半满和全空时较稳定,所以第ⅡA、ⅢA族以及第ⅤA、ⅥA主族存在反常,即同周期元素第ⅡA族的第一电离能大于第ⅢA族的第一电离能,第ⅤA族的第一电离能大于第ⅥA族的第一电离能,因此![]() 、
、![]() 、
、![]() 原子的第一电离能由大到小的顺序是N>O>C。
原子的第一电离能由大到小的顺序是N>O>C。
(4)配合物K3Fe(CN)6的配体是CN-,有14个电子,因此与其互为等电子体的分子有两种:CO或N2;(CN)2是直线型分子且具有对称性,可以判断碳氮之间形成三键,碳碳之间为单键连接,其结构式为N≡C-C≡N,因此![]() 键有4个,
键有4个,![]() 键有3个,个数比为
键有3个,个数比为![]() 。
。
(5)由晶胞结构图可知:K+位于体心,F-位于棱上,Mg2+位于顶点,因此每个晶胞中有1个K+、1/4×12=3个F-,1/8×8=1个Mg2+,则该晶体的化学式为KMgF3。
【题型】综合题
【结束】
12
【题目】某树脂的合成线路如下:
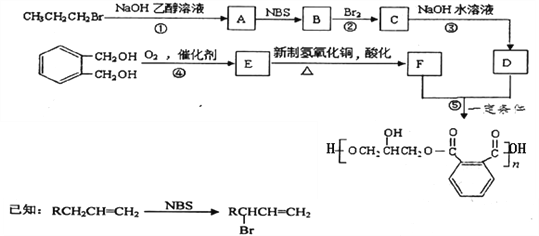
(1)B中含有的官能团的名称是________________________。
(2)反应①、③的有机反应类型分别是________________、____________________。
(3)检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是_______________。
(4)下列说法正确的是__________(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2mol Ag
b.可以用NaHCO3鉴别E和F
c.B分子存在顺反异构
(5)写出反应⑤的化学方程式______________________________________________。
(6)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com