
【题目】一定条件下,A、B、C的起始浓度分别是0.5mol/L、0.1 mol/L、1.6mol/L,可逆反应A(g)+B(g)![]() 2C(g)达到平衡时,下列数据合理的是
2C(g)达到平衡时,下列数据合理的是
A. c(A)=1.0mol/L c(B)=0.2mol/L B. c(B)=0.5mol/L c(C)=1.2mol/L
C. c(A)=0.4mol/L c(C)=1.8mol/L D. c(A )=0.9mol/L c(B)=0.5mo/L
【答案】D
【解析】A(g)+B(g)![]() 2C(g)
2C(g)
起始量 (mol/L) 0.5 0.1 1.6
正向进行极值转化 0.4 0 1.8
逆向进行极值转化 1.3 0.9 0
达到平衡状态时:0.4mol/L<c(A)<1.3mol/L,0<c(B)<0.9 mol/L,0<c(C)<1.8mol/L。A、如果c(A)=1.0mol/L,A增加0.5mol/L,则c(B)=0.6mol/L,A错误;B、如果c(B)=0.5mol/L,则C减少0.8mol/L,则c(C)=0.8mol/L,B错误;C、根据以上分析可知C不符合;D、如果c(A )=0.9mol/L则,A增加0.4mol/L,则c(B)=0.5mo/L,D符合,答案选D。


科目:高中化学 来源: 题型:
【题目】氯化钡有剧毒,致死量为0.3g,万一不慎误服,应大量吞服鸡蛋清及适量解毒剂,此解毒剂是( )
A.AgNO3
B.CuSO4
C.MgSO4
D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制备化工原料H2SO4和清洁能源H2
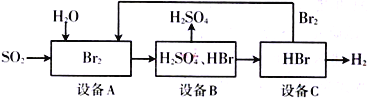
下列说法中不正确的是
A. 设备A中的溴水褪色,体现了SO2的还原性
B. 该生产工艺的优点:Br2可以循环利用,并获得清洁能源H2
C. 该工艺流程的总反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr
D. 设备C中是否残余H2SO4,可在C的样品溶液中加入BaCl2溶液,观察是否有沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列关于有机物的问题:
(1)下列有机物属于酯类的是_________(填正确答案编号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.CH3CH2OH
D.CH3CH2OH
(2)下列有机物不能发生水解反应的是__________(填正确答案编号)
A.油脂 B.葡萄糖 C.纤维素 D.蛋白质
(3)下列有机物属于芳香族化合物的是____(填正确答案编号,下同),与环己烷互为同系物的是_____,能使溴的四氯化碳溶液褪色的是___________;D和H2反应的化学方程式是____________。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测站经常测定水中溶解氧的情况,主要步骤是量取100mL水样,迅速加入固定剂MnSO4和碱性KI(含KOH)溶液,完全反应后加入硫酸使之生成I2,再用0.0040mol/L的Na2S2O3溶液与之反应。有关反应的化学方程式为:
①2MnSO4+O2+4KOH=2MnO(OH)2+2K2SO4(该反应极快)
②MnO(OH)2+2KI+2H2SO4=MnSO4+I2+K2SO4+3H2O
③I2+2Na2S2O3=2NaI+Na2S4O6
(1)若该水样消耗20.00mLNa2S2O3溶液,所耗Na2S2O3的物质的量为________mol。
(2)试计算该水样中的溶解氧_____(g/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】起始时向密闭容器中充入amolNO2(g),反应 2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通bmolNO2(g),又达到平衡时,下列说法中不正确的是( )
N2O4(g)达到平衡后,再向容器内通bmolNO2(g),又达到平衡时,下列说法中不正确的是( )
A. 恒温恒压和恒温恒容条件下,NO2 的物质的量都增大
B. 恒温恒压和恒温恒容条件下,NO2 的物质的量浓度都增大
C. 恒温恒压和恒温恒容条件下,NO2 转化率前者不变,后者增大
D. 恒温恒压和恒温恒容条件下,混合气体的平均摩尔质量前者不变,后者增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是
A. 氧化剂 B. 还原剂 C. 催化剂 D. 载体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com