
ЁОЬтФПЁПЕЊдЊЫиЕФЛЏКЯЮядкЙЄХЉвЕвдМАЙњЗРПЦММжагУЭОЙуЗКЃЌЕЋвВЛсЖдЛЗОГдьГЩЮлШОЃЌШчЕиЯТЫЎжаЯѕЫсбЮдьГЩЕФЕЊЮлШОвбГЩЮЊвЛИіЪРНчадЕФЛЗОГЮЪЬтЁЃ
ЃЈ1ЃЉЩёжлдиШЫЗЩДЌЕФЛ№М§ЭЦНјЦїжаГЃгУыТЃЈN2H4ЃЉзїШМСЯЁЃNH3гыNaClOЗДгІПЩЕУЕНыТЃЈN2H4ЃЉЃЌИУЗДгІжаБЛбѕЛЏгыБЛЛЙдЕФдЊЫиЕФдзгИіЪ§жЎБШЮЊ___ЁЃШчЙћЗДгІжага5molЕчзгЗЂЩњзЊвЦЃЌПЩЕУЕН___ gыТЁЃ
ЃЈ2ЃЉГЃЮТЯТЯђ25mL0.01mol/LЯЁбЮЫсжаЛКЛКЭЈШы5.6mLNH3ЃЈБъзМзДПіЃЌШмвКЬхЛ§БфЛЏКіТдВЛМЦЃЉЃЌЗДгІКѓШмвКжаРызгХЈЖШгЩДѓЕНаЁЕФЫГађЪЧ___ЁЃдкЭЈШыNH3ЕФЙ§ГЬжаШмвКЕФЕМЕчФмСІ___ЃЈЬюаДЁАБфДѓЁБЁЂЁАБфаЁЁБЛђЁАМИКѕВЛБфЁБЃЉЁЃ
ЃЈ3ЃЉЯђЩЯЪіШмвКжаМЬајЭЈШыNH3ЃЌИУЙ§ГЬжаРызгХЈЖШДѓаЁЙиЯЕПЩФме§ШЗЕФЪЧ___ЃЈбЁЬюБрКХЃЉЁЃ
aЃЎ[Cl-]=[NH4+]ЃО[H+]=[OH-] bЃЎ[Cl-]ЃО[NH4+]=[H+]ЃО[OH-
cЃЎ[NH4+]ЃО[OH-]ЃО[Cl-]ЃО[H+] dЃЎ[OH-]ЃО[NH4+]ЃО[H+]ЃО[Cl-]
ЃЈ4ЃЉГЃЮТЯТЯђ25mLКЌHCl0.01molЕФШмвКжаЕЮМгАБЫЎжСЙ§СПЃЌИУЙ§ГЬжаЫЎЕФЕчРыЦНКтЃЈЬюаДЕчРыЦНКтвЦЖЏЧщПіЃЉ___ЁЃЕБЕЮМгАБЫЎЕН25mLЪБЃЌВтЕУШмвКжаЫЎЕФЕчРыЖШзюДѓЃЌдђАБЫЎЕФХЈЖШЮЊ___molЁЄL-1ЁЃ
ЁОД№АИЁП2ЃК1 80 c(Cl-)ЃОc(NH4+)ЃОc(H+)ЃОc(OH-) МИКѕВЛБф ac ЯШе§ЯђвЦЖЏЃЌКѓФцЯђвЦЖЏ 0.4
ЁОНтЮіЁП
ЃЈ1ЃЉУПЩњГЩ1molN2H4ЪБЃЌNH3БфЮЊN2H4ЃЌNЛЏКЯМлДг-3Щ§ИпЕН-2Щ§ИпСЫ1ЃЌNaClOБфЮЊNaClЃЌClЛЏКЯМлДг+1НЕЕЭЕН-1НЕЕЭСЫ2ЃЌИљОнбѕЛЏЛЙдЗДгІжаЛЏКЯМлЩ§НЕзмЪ§ЯрЕШПЩжЊБЛбѕЛЏЕФNдзгКЭБЛЛЙдЕФClдзгИіЪ§БШЮЊ2ЃК1ЃЛУПЩњГЩ1molN2H4ЃЌзЊвЦ2molЕчзгЃЌЙЪзЊвЦ5molЕчзгЃЌдђЩњГЩ2.5molN2H4ЃЌМДжЪСПЮЊ2.5mol![]() 32gЁЄmol-1=80gЃЌЙЪД№АИЮЊЃК2ЃК1ЃЛ80ЃЛ
32gЁЄmol-1=80gЃЌЙЪД№АИЮЊЃК2ЃК1ЃЛ80ЃЛ
ЃЈ2ЃЉHClЕФЮяжЪЕФСП=0.01molЁЄL-1![]() 25mL
25mL![]() 10-3=2.5
10-3=2.5![]() 10-4molЃЌNH3ЕФЮяжЪЕФСП=
10-4molЃЌNH3ЕФЮяжЪЕФСП=![]() =2.5
=2.5![]() 10-4molЃЌHClКЭNH3ЧЁКУЭъШЋЗДгІЩњГЩNH4ClЃЌЫљЕУШмвКЮЊNH4ClШмвКЃЌИљОнЕчКЩЪиКуПЩЕУЃКc(NH4+)+c(H+)=c(Cl-)+c(OH-)ЃЌгЩгкNH4+ЫЎНтЯиЫсадЃЌШмвКжаРызгХЈЖШДѓаЁЮЊЃКc(Cl-)>c(NH4+)>c(H+)>c(OH-)ЃЛЭЈШыАБЦјЗЂЩњЕФРызгЗДгІЮЊЃКNH3+H+=NH4+ЃЌУПЯћКФ1molH+ЩњГЩ1molNH4+,ШмвКжаРызгХЈЖШВЛБфЃЌЕМЕчадМИКѕВЛБфЃЌЙЪД№АИЮЊЃКc(Cl-)>c(NH4+)> c(H+)>c(OH-)ЃЛМИКѕВЛБфЃЛ
10-4molЃЌHClКЭNH3ЧЁКУЭъШЋЗДгІЩњГЩNH4ClЃЌЫљЕУШмвКЮЊNH4ClШмвКЃЌИљОнЕчКЩЪиКуПЩЕУЃКc(NH4+)+c(H+)=c(Cl-)+c(OH-)ЃЌгЩгкNH4+ЫЎНтЯиЫсадЃЌШмвКжаРызгХЈЖШДѓаЁЮЊЃКc(Cl-)>c(NH4+)>c(H+)>c(OH-)ЃЛЭЈШыАБЦјЗЂЩњЕФРызгЗДгІЮЊЃКNH3+H+=NH4+ЃЌУПЯћКФ1molH+ЩњГЩ1molNH4+,ШмвКжаРызгХЈЖШВЛБфЃЌЕМЕчадМИКѕВЛБфЃЌЙЪД№АИЮЊЃКc(Cl-)>c(NH4+)> c(H+)>c(OH-)ЃЛМИКѕВЛБфЃЛ
ЃЈ3ЃЉЕчКЩЪиКуЃКcЃЈNH4+ЃЉ+c(H+)=c(Cl-)+c(OH-)ЃЌЕБШмвКГЪжаадЪБЃЌc(Cl-)=c(NH4+)> c(H+)=c(OH-)ЃЌЕБШмвКГЪМюадЪБc(NH4+)>c(OH-)> c(Cl-)>c(H+)ЃЌacЗћКЯЃЌЙЪД№АИЮЊЃКacЃЛ
ЃЈ4ЃЉЕЮМгЧАШмвКШмжЪЮЊHClЃЌвжжЦЫЎЕФЕчРыЃЌЕЮМгЕНЧЁКУЭъШЋЗДгІШмжЪЮЊNH4ClЃЌNH4+ЫЎНтЃЌбЮРрЫЎНтЃЌДйНјЫЎЕФЕчРыЃЌжСЙ§СПЃЌШмвКШмвКжаNH3ЁЄH2OХЈЖШдіДѓЃЌМювжжЦЫЎЕФЕчРыЃЌЫљвдећИіЙ§ГЬЫЎЕФЕчРыЦНКтЯШе§ЯђвЦЖЏЃЌКѓФцЯђвЦЖЏЃЛЕЮМгЕНЧЁКУЭъШЋЗДгІШмжЪЮЊNH4ClЪБЃЌЫЎЕФЕчРыГЬЖШзюДѓЃЌдђ0.01mol=c(NH3ЁЄH2O)![]() 25mL
25mL![]() 10-3ЃЌНтЕУc
10-3ЃЌНтЕУc
(NH3ЁЄH2O)=0.4molЁЄL-1ЃЌЙЪД№АИЮЊЃКЯШе§ЯђвЦЖЏЃЌКѓФцЯђвЦЖЏЃЛ0.4ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМБэЪОШмвКжаc(HЃЋ)КЭc(OHЃ)ЕФЙиЯЕЃЌЯТСаХаЖЯДэЮѓЕФЪЧ

A. СНЬѕЧњЯпМфШЮвтЕуОљгаc(HЃЋ)ЁСc(OHЃ)ЃНKw
B. MЧјгђФкШЮвтЕуОљгаc(HЃЋ)ЃМc(OHЃ)
C. ЭМжаT1ЃМT2
D. XZЯпЩЯШЮвтЕуОљгаpHЃН7
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЭМЪОгыЖдгІЕФа№Ъіе§ШЗЕФЪЧ
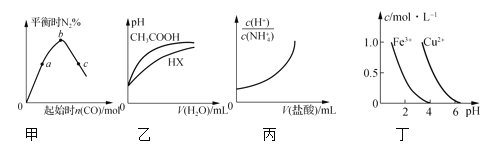
A.ЭММзБэЪОЗДгІ4CO(g)ЃЋ2NO2(g)![]() N2(g)ЃЋ4CO2(g)ЃЌБЃГжЦфЫћЬѕМўВЛБфЃЌИФБфCOЕФЮяжЪЕФСПЃЌЦНКтЪБN2ЕФЬхЛ§ЗжЪ§БфЛЏЧщПіЁЃгЩЭМПЩжЊЃЌNO2ЕФзЊЛЏТЪЃКcЃОbЃОa
N2(g)ЃЋ4CO2(g)ЃЌБЃГжЦфЫћЬѕМўВЛБфЃЌИФБфCOЕФЮяжЪЕФСПЃЌЦНКтЪБN2ЕФЬхЛ§ЗжЪ§БфЛЏЧщПіЁЃгЩЭМПЩжЊЃЌNO2ЕФзЊЛЏТЪЃКcЃОbЃОa
B.ЭМввБэЪО25ЁцЪБЃЌЗжБ№МгЫЎЯЁЪЭЬхЛ§ОљЮЊ100 mLЁЂpHЃН2ЕФCH3COOHШмвККЭHXШмвКЃЌдђ25ЁцЪБHXЕФЕчРыЦНКтГЃЪ§ДѓгкCH3COOHЕФЕчРыЦНКтГЃЪ§
C.ЭМБћБэЪО25ЁцЪБЃЌЯђ0.1 molЁЄLЃ1NH4ClШмвКжаЕЮМг0.1 molЁЄLЃ1бЮЫсЃЌШмвКЫцбЮЫсЬхЛ§ЕФБфЛЏЙиЯЕ
D.ИљОнЭМЖЁЃЌШєвЊГ§ШЅCuSO4ШмвКжаЕФFe3ЃЋЃЌашвЊЕїНкШмвКЕФpHдк7зѓгв
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNКЭSЪЧживЊЕФЗЧН№ЪєдЊЫиЃЌОлЕЊЛЏСђ(SN)xЪЧживЊЕФГЌЕМВФСЯЃЌФПЧАМКГЩЮЊШЋЧђВФСЯаавЕбаОПЕФШШЕуЁЃЛиД№ЯТСаЮЪЬтЃК
(1)ЯТСаЕчзгХХВМЭМФмБэЪОЕЊдзгЕФзюЕЭФмСПзДЬЌЕФЪЧ_____(ЬюзжФИ)ЁЃ
A.![]() B.
B.![]()
C.![]() D.
D.
(2)SдзгЕФЛљЬЌдзгКЫЭтга____ИіЮДГЩЖдЕчзгЃЌга__________жжВЛЭЌаЮзДЕФЕчзгдЦЁЃ
(3) SЁЂNЁЂOШ§жждЊЫиЕФЕквЛЕчРыФмгЩДѓЕНаЁЕФЫГађЮЊ________ЃЌСаОйвЛжжгыSCN-ЛЅЮЊЕШЕчзгЬхЕФЗжзгЮЊ_______ЁЃ
(4) (CH3)3NжаNдзгдгЛЏЗНЪНЮЊ_______ЃЛAsгыNЪЧЭЌжїзхдЊЫиЃЌAsH3ЕФЯрЖдЗжзгжЪСПБШNH3ДѓЃЌЪЕбщВтЕУAsH3ЗаЕуБШNH3ЕЭЃЌЦфдвђЪЧ___________ЁЃ
(5) GaNЪЧвЛжжживЊЕФАыЕМЬхВФСЯЃЌЦфОЇАћНсЙЙКЭН№ИеЪЏРрЫЦЃЌЦфОЇАћНсЙЙШчЭМЁЃ
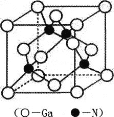
ЂйЕЊЛЏяижаЕЊдзггыяидзгжЎМфвд_______МќЯрНсКЯЃЌгыЭЌвЛИіGaдзгЯрСЌЕФNдзгЙЙГЩЕФПеМфЙЙаЭЮЊ_______ЁЃ
ЂкGaNОЇЬхЕФОЇАћБпГЄЮЊa pmЃЌФІЖћжЪСПЮЊM g/molЃЌАЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊNAЃЌдђGaNОЇЬхЕФУмЖШЮЊ_______gcm-3 (жЛвЊЧѓСаЫуЪНЃЌВЛБиМЦЫуГіНсЙћЃЌ1pm=l0-12m)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЯТСаЫЕЗЈвЛЖЈе§ШЗЕФЪЧ
A.25ЁцЃЌ12.0gNaHSO4ЙЬЬхжаКЌгаЕФбєРызгЪ§ФПЮЊ0.2NA
B.TЁцЪБЃЌ1LpH=6ЕФДПЫЎжаЃЌКЌгаЕФOHЃЪ§ФПЮЊ1ЁС10Ѓ8NA
C.2.24LN2КЭNH3ЛьКЯЦјЬхжадзгМфКЌгаЕФЙВгУЕчзгЖдЪ§ФПЮЊ0.3NA
D.2molSO2КЭ1molO2дквЛЖЈЬѕМўЯТГфЗжЗДгІКѓЃЌЫљЕУЛьКЯЦјЬхЕФЗжзгЪ§Дѓгк2NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗчУвШЋЧђЕФвћСЯЙћДзжаКЌгаЦЛЙћЫсЃЈMLAЃЉЃЌЦфЗжзгЪНЮЊC4H6O5ЁЃ0.1molЦЛЙћЫсгызуСПЕФNaHCO3ШмвКЗДгІФмВњЩњ4.48LCO2ЃЈБъзМзДПіЃЉЃЌЦЛЙћЫсЭбЫЎФмЩњГЩЪЙфхЫЎЭЪЩЋЕФВњЮяЁЃЦЛЙћЫсООлКЯЩњГЩОлЦЛЙћЫсѕЅЃЈPMLAЃЉЁЃ
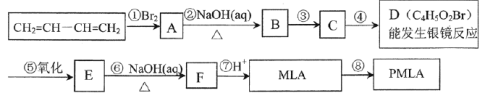
ЃЈ1ЃЉаДГіЮяжЪЕФНсЙЙМђЪНЃКA___ЃЌD___ЁЃ
ЃЈ2ЃЉжИГіКЯГЩТЗЯпжаЂйЁЂЂкЕФЗДгІРраЭЃКЂй___ЃЛЂк___ЁЃ
ЃЈ3ЃЉаДГіЫљгагыMLAОпгаЯрЭЌЙйФмЭХЕФЭЌЗжвьЙЙЬхЕФНсЙЙМђЪНЃК___ЁЃ
ЃЈ4ЃЉаДГіEЁњFзЊЛЏЕФЛЏбЇЗНГЬЪН___ЁЃ
ЃЈ5ЃЉЩЯЪізЊЛЏЙиЯЕжаВНжшЂлКЭЂмЕФЫГађФмЗёЕпЕЙ?___ЃЈЬюЁАФмЁБЛђЁАВЛФмЁБЃЉЁЃЫЕУїРэгЩЃК___ЁЃ
ЃЈ6ЃЉЧыаДГівдБћЯЉЮЊдСЯжЦБИШщЫсЃЈ2-єЧЛљБћЫсЃЉЕФКЯГЩТЗЯпСїГЬЭМЃЈЮоЛњЪдМСШЮШЁЃЉ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБЅКЭЪГбЮЫЎжаМгШыЬМЫсЧтяЇПЩжЦБИаЁЫеДђЃЌТЫГіаЁЫеДђКѓЃЌЯђФИвКжаЭЈШыАБЃЌдйРфШДЁЂМгЪГбЮЃЌЙ§ТЫЃЌЕУЕНТШЛЏяЇЙЬЬхЃЎЯТСаЗжЮіДэЮѓЕФЪЧЃЈЁЁЁЁЃЉ
A.ИУжЦБИаЁЫеДђЕФЗНГЬЪНЮЊЃКNaCl+NH4HCO3ЁњNaHCO3Ё§+NH4Cl
B.ФИвКжаЭЈШыЕФАБЦјгыHCO3ЉЗДгІЃКNH3+HCO3ЉЁњCO32Љ+NH4+
C.МгЪГбЮЪЧЮЊдіДѓШмвКжаClЉЕФХЈЖШ
D.гЩЬтПЩжЊЮТЖШНЯЕЭЪБЃЌТШЛЏяЇЕФШмНтЖШБШТШЛЏФЦЕФДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCl2МАЦфЛЏКЯЮядкЩњВњЁЂЩњЛюжаОпгаЙуЗКЕФгУЭОЃЎНЋТШЦјШмгкЫЎФмаЮГЩТШЦјЉТШЫЎЬхЯЕЃЎ
ЭъГЩЯТСаЬюПеЃК
ЃЈ1ЃЉТШдзгзюЭтВуЕчзгЕФЕчзгХХВМЪНЪЧ__ЃЎгыЕчзгХХВМЪНЯрБШЃЌЙьЕРБэЪОЪНдіМгСЫЖдКЫЭтЕчзгдЫЖЏзДЬЌжа__УшЪіЃЎ
ЃЈ2ЃЉЧтЁЂТШЁЂбѕШ§жждЊЫиИїФмаЮГЩвЛжжМђЕЅвѕРызгЃЌАДРызгАыОЖгЩДѓЕНаЁЕФЫГађХХСаетаЉРызг__ЃЎ
ЃЈ3ЃЉТШЦјЉТШЫЎЬхЯЕжаЃЌДцдкЖрИіКЌТШдЊЫиЕФЦНКтЙиЯЕЃЌЧыЗжБ№гУЦНКтЗНГЬЪНБэЪОЃК__ЃЎвбжЊHClOЕФЩБОњФмСІБШClOЉЧПЃЌТШДІРэвћгУЫЎЪБЃЌдкЯФМОЕФЩБОњаЇЙћБШдкЖЌМОВюЃЌПЩФмдвђЪЧ__ЃЈвЛжждвђМДПЩЃЉЃЎ
ЃЈ4ЃЉдкТШЫЎжаЃЌЯТСаЙиЯЕе§ШЗЕФЪЧ__ЃЈбЁЬюБрКХЃЉЃЎ
a cЃЈHClOЃЉ+cЃЈClOЉЃЉ=cЃЈH+ЃЉЉcЃЈOHЉЃЉ
b cЃЈH+ЃЉ=cЃЈClOЉЃЉ+cЃЈClЉЃЉ+cЃЈOHЉЃЉ
c cЃЈHClOЃЉЃМcЃЈClЉЃЉ
d cЃЈClЉЃЉЃМcЃЈOHЉЃЉ
ЃЈ5ЃЉClO2ЪЧвЛжжИќИпаЇЁЂАВШЋЕФЯћЖОМСЃЌЙЄвЕЩЯПЩгУClO2гыЫЎжаЕФMnCl2дкГЃЮТЯТЗДгІЃЌЩњГЩMnO2КЭбЮЫсЃЌвдГ§ШЅЫЎжаMn2+ЃЌаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃЈашХфЦНЃЉ__ЃЎгаШЫШЯЮЊВњЮяMnO2КЭбЮЫсЛсМЬајЗДгІЩњГЩТШЦјЃЌетжжШЯЪЖЖдТ№ЃП__ЃЈЬюЁАЖдЁБЛђЁАДэЁБЃЉЃЌЫЕУїРэгЩ__ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщжЦШЁТШЫсМиКЭТШЫЎВЂНјаагаЙиЬНОПЪЕбщЁЃ
ЪЕбщвЛ жЦШЁТШЫсМиКЭТШЫЎ
РћгУШчЭМЫљЪОЕФЪЕбщзАжУНјааЪЕбщЁЃ
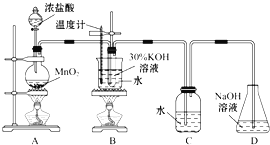
ЃЈ1ЃЉжЦШЁЪЕбщНсЪјКѓЃЌШЁГіBжаЪдЙмРфШДНсОЇЃЌЙ§ТЫЃЌЯДЕгЁЃИУЪЕбщВйзїЙ§ГЬашвЊЕФВЃСЇвЧЦїга______ЁЃ
ЃЈ2ЃЉШєЖдЕїBКЭCзАжУЕФЮЛжУЃЌ_____ЃЈЬюЁАПЩФмЁБЛђЁАВЛПЩФмЁБЃЉЬсИпBжаТШЫсМиЕФВњТЪЁЃ
ЪЕбщЖў ТШЫсМигыЕтЛЏМиЗДгІЕФбаОП
ЃЈ3ЃЉдкВЛЭЌЬѕМўЯТKClO3ПЩНЋKIбѕЛЏЮЊI2ЛђKIO3ЁЃИУаЁзщЩшМЦСЫЯЕСаЪЕбщбаОПЗДгІЬѕМўЖдЗДгІВњЮяЕФгАЯьЃЌЦфжаЯЕСаaЪЕбщЕФМЧТМБэШчЯТЃЈЪЕбщдкЪвЮТЯТНјааЃЉЃК
ЪдЙмБрКХ | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3ЃЈsЃЉ/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
еєСѓЫЎ/mL | 9.0 | 6.0 | 3.0 | 0 |
ЪЕбщЯжЯѓ |
ЂйЯЕСаaЪЕбщЕФЪЕбщФПЕФЪЧ______ЁЃ
ЂкЩшМЦ1КХЪдЙмЪЕбщЕФзїгУЪЧ______ЁЃ
ЂлШє2КХЪдЙмЪЕбщЯжЯѓЪЧШмвКБфЮЊЛЦЩЋЃЌШЁЩйСПИУШмвКМгШы______ШмвКЯдРЖЩЋЁЃ
ЪЕбщШ§ ВтЖЈБЅКЭТШЫЎжаТШдЊЫиЕФзмСП
ЃЈ4ЃЉИљОнЯТСазЪСЯЃЌЮЊИУаЁзщЩшМЦвЛИіМђЕЅПЩааЕФЪЕбщЗНАИЃЈВЛБиУшЪіВйзїЙ§ГЬЕФЯИНкЃЉЃК_____ЁЃ
зЪСЯЃКЂйДЮТШЫсЛсЦЦЛЕЫсМюжИЪОМСЃЛ
ЂкДЮТШЫсЛђТШЫЎПЩБЛSO2ЁЂH2O2КЭFeCl2ЕШЮяжЪЛЙдГЩCl-ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com