
【题目】常温下,下列溶液均为![]() ,有关叙述正确的是( )
,有关叙述正确的是( )
A.碳酸氢钠溶液中![]()
B.碳酸钠溶液比碳酸氢钠溶液的pH小
C.碳酸钠溶液中![]()
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质只有NaCl
【答案】A
【解析】
A.碳酸氢钠溶液显碱性,是HCO3-的水解大于HCO3-电离缘故,则溶液中![]() ,故A正确;
,故A正确;
B.碳酸钠溶液中CO32-的水解程度比碳酸氢钠溶液中HCO3-的水解程度大,则Na2CO3的碱性强,即碳酸钠溶液pH大,故B错误;
C.碳酸钠溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒式为c(Na+)=2c(CO32-)+2c(H CO3-)+2c(H2CO3),将物料守恒式c(Na+)代入电荷守恒式得c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-),故C错误;
D.碳酸钠溶液中滴加盐酸至pH=7,所得溶液的溶质除NaCl,还可能含有少量H2CO3与NaHCO3,故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
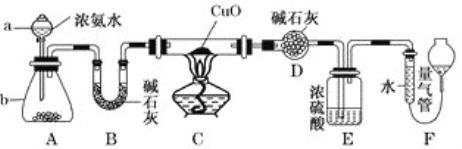
(1)仪器b中的试剂可能为__________________。
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,上述现象证明NH3具有____________性,写出相应的化学方程式_____________________________________。
(3)E装置中浓硫酸的作用______________________________________________。
(4)读取气体体积前,应对装置F进行的操作:_______________________。
(5)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。
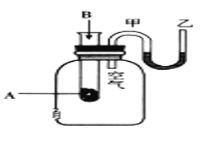
试回答下列问题:
(1)该反应为_______反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低”)。
(3)反应物化学键断裂吸收的能量_______(填“高”或“低”)于生成物化学键形成放出的能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )
A.KNO3是氧化剂,KNO3中N元素被氧化
B.生成物中的Na2O是氧化产物,K2O是还原产物
C.每转移1mole﹣,可生成标准状况下N2的体积为35.84升
D.若有65gNaN3参加反应,则被氧化的N的物质的量为3.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如图(a为活塞,加热及固定装置已略去)。

(1)连接仪器、___、加药品后,打开 a,然后滴入浓硫酸,加热;
(2)铜与浓硫酸反应制备 SO2的化学方程式是___;
(3)品红溶液中的实验现象是___;
(4)从高锰酸钾溶液中观察到的现象说明 SO2具有___性。
Ⅱ、上述实验中 NaOH 溶液用于吸收剩余的 SO2 生成 Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性溶液中Br2氧化Na2SO3的离子方程式___
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告。___
限选试剂:2mol·L-1HCl;1mol·L-1H2SO4;lmol·L-1BaCl2;lmol·L-1Ba(NO3)2;0.1mol·L-1AgNO3;CCl4;新制氯水。
编号 | 实验操作 | 预期现象和结论 |
步骤① | 取少量待测液加入试管中,加入过量的2mol·L-1盐酸,再滴加 | 有 生成,证明待测液中SO42- |
步骤② | 取出步骤①中适量上层清液于试管中,加入适量氯水,再加入 ,振荡,静置。 | 下层液体呈 ,证明待测液中含Br-。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2+3H2![]() 2NH3,开始时N2的浓度为3 mol·L-1,H2的浓度为5 mol·L-1,3 min后测得NH3浓度为0.6 mol·L-1,则此时间内,下列反应速率表示正确的是( )
2NH3,开始时N2的浓度为3 mol·L-1,H2的浓度为5 mol·L-1,3 min后测得NH3浓度为0.6 mol·L-1,则此时间内,下列反应速率表示正确的是( )
A.v(H2)=0.3 mol·L-1·min-1B.v(N2)=1.0 mol·L-1·min-1
C.v(NH3)=0.2 mol·L-1·s-1D.v(H2)=1.67 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com