
【题目】一定条件下,密闭容器中发生反应Mg)N(g),反应过程中的能量变化如图中曲线所示,下列说法错误的是

A.该反应正反应活化能为E3-E2
B.该反应的△H=E1-E2
C.曲线Ⅱ表示其他条件不变,升高温度时的能量变化
D.曲线Ⅲ表示其他条件不变,加入催化剂时的能量变化
科目:高中化学 来源: 题型:
【题目】下列解释过程或事实的方程式不正确的是( )
A.氯气用于自来水消毒:Cl2+H2O=HCl+HClO
B.铁可以和稀硫酸反应:2Fe+3H2SO4=Fe2(SO4)3 +3H2↑
C.刻制印刷电路板时常用氯化铁溶液作为“腐蚀液”刻蚀铜板 2Fe3++Cu=2Fe2++ Cu2+.
D.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe + 4H2O(g)![]() Fe3O4 + 4H2
Fe3O4 + 4H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是亚硝酸根离子与钠离子组成的工业盐,具有咸味,其水溶液呈碱性.亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.加热到320℃以上则分解,生成氧气,氮气和氧化钠,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2.
(1)人体正常的血红蛋白含有Fe2+.若误食NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是___________________________(填序号).
A.亚硝酸盐被还原 B.维生素C是氧化剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是氧化剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号).
A.测定这两种溶液的pH B.用筷子蘸取固体品尝味道
C.加强热收集气体检验 D.用HNO3酸化的AgNO3鉴别
(3)亚硝酸钠受热分解的化学反应方程式为:4NaNO2![]() 2N2↑+3O2↑+2Na2O
2N2↑+3O2↑+2Na2O
①从氧化还原反应角度分析,该反应说明NaNO2具有_____________________.(填氧化性、还原性或者既有氧化性又有还原性)
②该反应中的还原产物为______________________(写名称)
③若反应中转移3mol电子,得到Na2O的质量为________________g.
(4)己知Cl2具有强氧化性,能将溶液中的NO2﹣氧化为NO3﹣同时生成盐酸,请写出NaNO2溶液中通入Cl2的离子反应方程式____________________________________________________________________________.
(5)某工厂废液中,含2%~5%的NaNO2,直接排放会造成污染,NH2Cl能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为______________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO2![]() Fe+3CO2
Fe+3CO2
D.2KMnO4![]() K2MnO4MnO2+O2↑
K2MnO4MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示
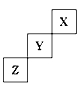
(1)X元素的名称是___________。
(2)Y在元素周期表中的位置是__________,它形成单质的化学式是_________。
(3)Z元素的原子结构示意图为__________。写出Z单质与铁反应的化学反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用酚酞作指示剂,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
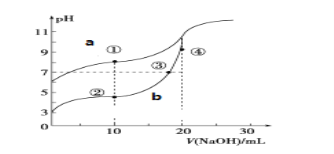
(1)图__(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是__。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:__。
(3)点①和点② 所示溶液中:c(CH3COO-)-c(CN-)__c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3 、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
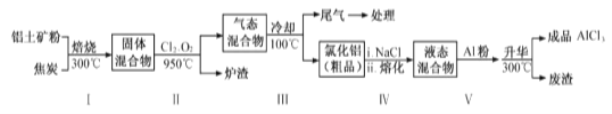
已知:

①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_____(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_________________________。
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。

根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____(填“A”或“B”)。
(2)NH3·H2O的电离常数为_____。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com