
【题目】如图是一个化学过程的示意图,回答下列问题:
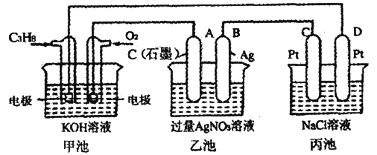
(1)甲池是___________装置,电极B的名称是___________。
(2)甲装置中通入C3H8的电极反应____________,丙装置中D极的产物是___________(写化学式)。
(3)一段时间,当乙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的pH=__________。(已知:NaCl溶液足量,电解后溶液体积为200 mL)。
(4)若要使乙池恢复电解前的状态,应向乙池中加入__________(写物质化学式)。
【答案】原电池 阴极 C3H8+26OH--20e-=3CO32-+17H2O H2、NaOH 13 Ag2O
【解析】
(1)甲池为丙烷、氧气形成的燃料电池;乙池中电极B与原电池的负极连接,作电解池的阴极;
(2)C3H8在负极上失电子,碱性条件下生成碳酸根;丙装置中D极连接电源的负极,为阴极;
(3)电解AgNO3溶液,总反应方程式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3,根据n=
4Ag+O2↑+4HNO3,根据n=![]() 计算O2的物质的量,根据同一闭合回路中电子转移的物质的量相等,在丙池中:阴极上氢离子放电,阳极上氯离子放电,根据电子转移数目相等计算氢氧化钠的物质的量,利用c=
计算O2的物质的量,根据同一闭合回路中电子转移的物质的量相等,在丙池中:阴极上氢离子放电,阳极上氯离子放电,根据电子转移数目相等计算氢氧化钠的物质的量,利用c=![]() 计算氢氧化钠的物质的量浓度,从而得出溶液的pH;
计算氢氧化钠的物质的量浓度,从而得出溶液的pH;
(4)根据电解的产物分析,根据“析出什么元素加入什么元素”的原则确定使乙池恢复电解前的状态加入的物质。
根据装置图可知甲池为原电池,通入燃料丙烷的电极为负极,通入O2的电极为正极,乙池、丙池与原电池连接,属于电解池,其中乙池中A电极为阳极,B电极为阴极,丙池中C电极为阳极,D电极为阴极。
(1)甲池为原电池,是化学能转化为电能的装置,乙池为电解池,其中B电极连接电源的负极,作阴极;
(2)燃料C3H8在负极上失电子,碱性条件下反应生成CO32-,所以甲装置中通入C3H8的电极反应式为:C3H8+26OH--20e-=3CO32-+17H2O。丙装置中C电极为阳极,溶液中Cl-失去电子变为Cl2;D极为阴极,电极上水电离产生的H+放电生成H2,溶液中有OH-,所以D电极的产物是H2和NaOH;
(3)乙装置中A(石墨)电极为阳极,发生反应:4OH- -4e-=2H2O+O2↑,B(Ag)的电极为银离子得电子,其电极反应式为:Ag++e-=Ag。n(O2)=![]() =0.005 mol,根据电极反应式可知:每反应产生1 molO2,转移4 mol电子,则反应产生0.005 mol电子时,转移电子的物质的量n(e-)=4n(O2)=0.02 mol。丙池电解反应方程式为:2NaCl+2H2O
=0.005 mol,根据电极反应式可知:每反应产生1 molO2,转移4 mol电子,则反应产生0.005 mol电子时,转移电子的物质的量n(e-)=4n(O2)=0.02 mol。丙池电解反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,根据方程式可知:每反应转移2 mol电子,反应产生2 mol NaOH,由于在同一闭合回路中电子转移数目相等,所以转移0.02 mol电子时,丙池反应产生NaOH的物质的量n(NaOH)= n(e-)=0.02 mol,NaCl溶液足量,电解后溶液体积为200 mL,所以反应后c(NaOH)=
2NaOH+H2↑+Cl2↑,根据方程式可知:每反应转移2 mol电子,反应产生2 mol NaOH,由于在同一闭合回路中电子转移数目相等,所以转移0.02 mol电子时,丙池反应产生NaOH的物质的量n(NaOH)= n(e-)=0.02 mol,NaCl溶液足量,电解后溶液体积为200 mL,所以反应后c(NaOH)=![]() =0.1 mol/L,c(H+)=
=0.1 mol/L,c(H+)=![]() mol/L=10-13 mol/L,所以溶液pH=13;
mol/L=10-13 mol/L,所以溶液pH=13;
(4)对于乙池,总反应方程式为:4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3,由于电解生成Ag和O2从溶液中分离出去,所以要使乙池恢复电解前的状态,应向乙池中加入二者的化合物,即加入Ag2O。
4Ag+O2↑+4HNO3,由于电解生成Ag和O2从溶液中分离出去,所以要使乙池恢复电解前的状态,应向乙池中加入二者的化合物,即加入Ag2O。


科目:高中化学 来源: 题型:
【题目】风靡全球的饮料果醋中含有苹果酸(MLA),其分子式为C4H6O5。0.1mol苹果酸与足量的NaHCO3溶液反应能产生4.48LCO2(标准状况),苹果酸脱水能生成使溴水褪色的产物。苹果酸经聚合生成聚苹果酸酯(PMLA)。
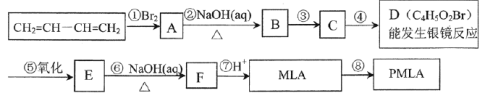
(1)写出物质的结构简式:A___,D___。
(2)指出合成路线中①、②的反应类型:①___;②___。
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式:___。
(4)写出E→F转化的化学方程式___。
(5)上述转化关系中步骤③和④的顺序能否颠倒?___(填“能”或“不能”)。说明理由:___。
(6)请写出以丙烯为原料制备乳酸(2-羟基丙酸)的合成路线流程图(无机试剂任取)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成芳香族有机高聚物P的合成路线.
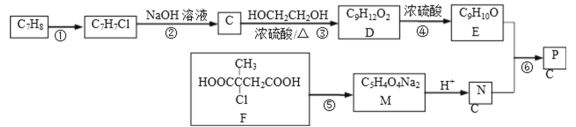
已知:ROH+R’OH![]() ROR’+H2O
ROR’+H2O
完成下列填空:
(1)F中官能团的名称__;写出反应①的反应条件__;
(2)写出反应⑤的化学方程式__.
(3)写出高聚物P的结构简式__.
(4)E有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式__.
①分子中只有苯环一个环状结构,且苯环上有两个取代基;
②1mol该有机物与溴水反应时消耗4molBr2
(5)写出以分子式为C5H8的烃为主要原料,制备F的合成路线流程图(无机试剂任选)__.合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3.
CH3COOCH2CH3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等.
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取.高温下制取纯硅有如下反应(方法Ⅰ):
①SiO2(s)+2C(s)Si(s)+2CO(g)
②Si(s)+2Cl2(g)SiCl4(g)
③SiCl4(g)+2H2(g)→Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有______ 种不同能级的电子,最外层p电子有______种自旋方向;SiO2晶体中每个硅原子与______个氧原子直接相连.
(2)单质的还原性:碳______硅(填写“同于”、“强于”或“弱于”).从平衡的视角而言,反应①能进行的原因是______.
(3)反应②生成的化合物分子空间构型为;该分子为______分子(填写“极性”或“非极性”).
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L.然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L.则:a______b(填写“大于”、“等于”或“小于”).
(5)在t秒内,反应②中反应速率v(SiCl4)=______(用含a、b的代数式表示).
(6)工业上还可以通过如下反应制取纯硅(方法Ⅱ):
④Si(粗)+3HCl(g)![]() SiHCl3(l)+H2(g)+Q(Q>0)
SiHCl3(l)+H2(g)+Q(Q>0)
⑤SiHCl3(g)+H2(g)![]() Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有:______、______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
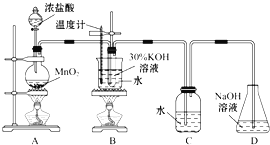
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol/L氢硫酸溶液中含有的H+数为2NA
C.100mL18.4mol/L的浓硫酸与足量铜反应,生成SO2的分子为0.92mol
D.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇,俗称酒精,可用于制造乙酸、饮料、香精、染料、燃料等。
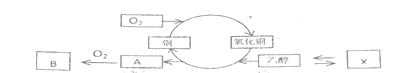
(1)请写出结构简式A:___,B:___。
(2)图示流程中乙醇转化为A,该反应现象为:___,其中乙醇发生了___反应(填“氧化"或”还原“)。乙二醇(HO-CH2-CH2-OH)也能发生类似反应,请写出反应方程式:___。
(3)请你写出X的化学式___,并用相关反应方程式证实X可与乙醇相互转化___。
(4)工业上常用苹果酒或者葡萄酒混合物、麦芽、米或马铃薯捣碎后发酵生产乙酸,但是从绿色化学角度,该法存在不足,请写出一个不足之处:___,但相比于直接用工业酒精,该法原料与产品均无害,至令仍沿用。
(5)乙酸与乙醇在一定条件下可反应生成乙酸乙酯,请用氧-18同位素示踪法写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是一种高效氧化剂可用来氧化吸附有机异味物.也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用Na2C2O4标准溶液标定未知浓度的KMnO4溶液,发生反应:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2↑。根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的_______区,基态Mn2+的核外电子排布式可表示为_____。
(2)1 mol [Mn( H2O)6]2+中所含有的共价键数目为__________。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为_______.C2O42-中碳原子的轨道杂化类型是___________________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:H2O>H2Se>H2S,原因是__________。
(5)β-MnSe的结构中Se为面心立方最密堆积,晶胞结构如图所示。
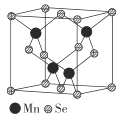
①β-MnSe中Mn的配位数为_____________。
②若该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为______pm, β-MnSe 的密度ρ= ______ ( 列出表达式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煅烧黄铁矿(主要成分为FeS2)所得的矿渣中含Fe2O3、SiO2、Al2O3、MgO等.用该矿渣可制备铁红(Fe2O3).完成下列填空:
(1)煅烧黄铁矿的化学方程式____,反应过程中被氧化的元素____.
(2)矿渣中属于两性氧化物的是___,写出Fe2O3与稀硫酸反应的离子方程式__.
(3)Al(OH)3的碱性比Mg(OH)2的碱性___(选填“强”或“弱”);铝原子最外层电子排布式为____.
(4)SiO2的熔点___ Fe2O3的熔点(填“大于”或“小于”),原因是__.
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为______(用表达式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com