
【题目】某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )

A.H2SO4浓度为4mol/L
B.溶液中最终溶质为FeSO4
C.原混合酸中NO3﹣浓度为0.2mol/L
D.AB段反应为:Fe+2Fe3+→3Fe2+
【答案】C
【解析】
试题分析:A、反应消耗22.4g铁,也就是22.4g÷56g/mol=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所以硫酸的浓度是4mol/l,A正确;B、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,B正确;C、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以n(NO3-)=2n(Fe)=![]() =0.4mol,浓度为4mol/L,C错误;D、由图像可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,D正确,答案选C。
=0.4mol,浓度为4mol/L,C错误;D、由图像可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,D正确,答案选C。


科目:高中化学 来源: 题型:
【题目】活性炭吸附法是工业 提碘的主要方法之一,其流程如下:
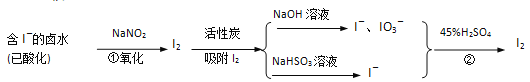
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的方向和数目___________________________________________________。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I-选择了价格并不便宜的亚硝酸钠,可能的原因是____________________________________。
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是_______________________________________。
(4)流程中,碘元素经过了I-→I2→I-、IO3-→I2的变化过程,这样反复操作的目的是___________。
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在两种程度不同的平衡体系:水解_______________________________和电离_______________________________(用离子方程式表示)
(6)如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
①加入少量Ba(OH)2固体,水解平衡向_________移动。
②加入少量NaClO固体,溶液的pH_________(选填:增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。KI还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I : 3I2+ 6KOH== KIO3 +5KI+ 3H2O
反应II: 3H2S+KIO3=3S↓+KI+ 3H2O

请回答有关问题。
(1)启普发生器中发生反应的化学方程式为_______。装置中盛装30%氢氧化钾溶液的仪器名称是_________。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液.待观察到三颈烧瓶中溶液颜色由棕黄色变为______(填现象) ,停止滴人KOH溶液;然后______(填操作),待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是_____________。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和___________(填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
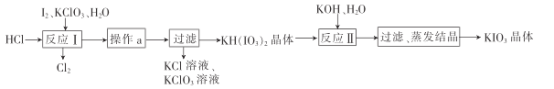
(5)实验室模拟工业制备KIO3流程如下:
几种物质的溶解度见下表:
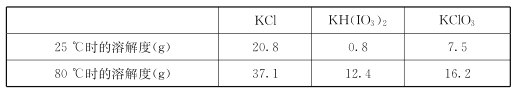
①由上表数据分析可知,“操作a”为__________________。
②用惰性电极电解KI溶液也能制备KIO3,与电解法相比,上述流程制备KIO3的缺点是____________。
(6)某同学测定.上述流程生产的KIO3样品的纯度。
取1.00 g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol●L-1 Na2S2O3 溶液,恰好完全反应时共消耗12. 60 mL Na2S2O3溶液。该样品中KIO3的质量分数为_______(已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸的结构如图所示。关于咖啡酸的描述不正确的是( )
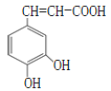
A.分子式为C9H8O4
B.1mol咖啡酸最多能与4mol氢气发生加成反应
C.遇溴水,既能发生取代反应又能发生加成反应
D.能还原酸性KMnO4溶液,说明其分子中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是短周期元素,
是短周期元素,![]() 元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;
元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;![]() 元素原子最外电子层上
元素原子最外电子层上![]() 、
、![]() 电子数相等;
电子数相等;![]() 元素的
元素的![]() 价阳离子的核外电子排布与氖原子相同;
价阳离子的核外电子排布与氖原子相同;![]() 元素原子的
元素原子的![]() 层有1个未成对的
层有1个未成对的![]() 电子。下列有关这些元素性质的说法一定正确的是( )
电子。下列有关这些元素性质的说法一定正确的是( )
A.![]() 元素的简单氢化物的水溶液显碱性
元素的简单氢化物的水溶液显碱性
B.![]() 元素的离子半径大于
元素的离子半径大于![]() 元素的离子半径
元素的离子半径
C.![]() 元素的单质在一定条件下能与
元素的单质在一定条件下能与![]() 元素的单质反应
元素的单质反应
D.![]() 元素的最高价氧化物在常温下不是气态
元素的最高价氧化物在常温下不是气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用稀HNO3和Cu制取少量NO并验证氮氧化合物性质的装置.下列说法错误的是( )

A.吸收剂可以是NaOH溶液B.试管上部的气体始终为无色
C.小试管中溶液最终呈蓝色D.试纸先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究SO2和氯水的漂白性,设计了如下实验,装置如图.完成下列填空:

(1)棉花上沾有的试剂是NaOH溶液,作用是______.
(2)①反应开始一段时间后,B、D两个试管中可以观察到的现象分别是:B:_____,D:____.
②停止通气后,分别加热B、D两个试管,可以观察到的现象分别是:B:_____,D:____.
(3)有同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不理想.产生该现象的原因(用化学方程式表示)______.
(4)装置E中用_____(填化学式)和浓盐酸反应制得Cl2,生成2.24L(标准状况)的Cl2,则被氧化的HCl为____mol.
(5)实验结束后,检验蘸有试剂的棉花含有SO42﹣的实验方案是:取棉花中的液体少许,滴加足量的稀HNO3,再加入几滴BaCl2溶液,出现白色沉淀.该方案是否合理____,理由是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
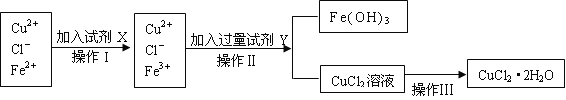
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是
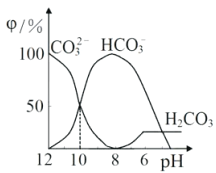
A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O![]() HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com