
����Ŀ���ⱻ��Ϊ������Ԫ����,��ѧ�����ز����ɷ��ε�ȱ����,KI��KIO3���Ⱥ����ڼӵ����С�KI�������ڷ����Լ����й���ϡ���ҩ��,���Ʊ�ԭ������:
��ӦI : 3I2+ 6KOH== KIO3 +5KI+ 3H2O
��ӦII: 3H2S+KIO3=3S��+KI+ 3H2O

��ش��й����⡣
(1)���շ������з�����Ӧ�Ļ�ѧ����ʽΪ_______��װ����ʢװ30%����������Һ������������_________��
(2)�ر����շ���������,�ȵ���30%��KOH��Һ.���۲쵽������ƿ����Һ��ɫ���ػ�ɫ��Ϊ______(������) ,ֹͣ����KOH��Һ;Ȼ��______(�����),��������ƿ���ձ��в������ݵ����ʽӽ����ʱֹͣͨ����
(3)����������Һ,����������ƿ�е���Һ����ˮԡ����,��Ŀ����_____________��
(4)��������ƿ�е���Һ�����ձ���,����̼�ᱵ,�ڹ������й���,���˵õ��ij����г����й���̼�ᱵ��,���������ᱵ��___________(������)���ϲ���Һ��ϴ��Һ,�����������ᾧ������ó�Ʒ��
(5)ʵ����ģ�ҵ�Ʊ�KIO3��������:
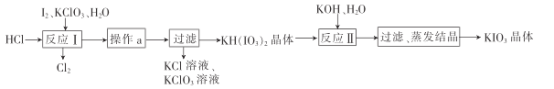
�������ʵ��ܽ�ȼ��±�:
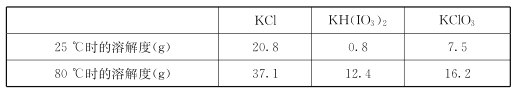
�����ϱ����ݷ�����֪��������a��Ϊ__________________��
���ö��Ե缫���KI��ҺҲ���Ʊ�KIO3,���ⷨ��ȣ����������Ʊ�KIO3��ȱ����____________��
(6)ijͬѧ�ⶨ.��������������KIO3��Ʒ�Ĵ��ȡ�
ȡ1.00 g��Ʒ��������ˮ�в��������ữ���ټ��������KI�������ĵ�����Һ����εμ�2.0 mol��L-1 Na2S2O3 ��Һ,ǡ����ȫ��Ӧʱ������12. 60 mL Na2S2O3��Һ������Ʒ��KIO3����������Ϊ_______(��֪��Ӧ:I2+2Na2S2O3=2NaI+Na2S4O6)��
���𰸡�ZnS+H2SO4===H2S��+ZnSO4 ��ѹ��Һ©�� ��ɫ �����շ�����������ͨ������ ʹ��Һ�ữ�����ȣ���������Һ��ʣ��������ݳ����Ӷ���ȥ���� �� ����Ũ������ȴ�ᾧ(���ؽᾧ) KClO3��I2��Ӧʱ������ж�����������Ⱦ������ 89.88%
��������
ʵ�����Ϊ���ȹر����շ�������������������ƿ�е���30%��KOH��Һ��������ӦI : 3I2+ 6KOH== KIO3 +5KI+ 3H2O�����ⵥ����ȫ��Ӧ��Ȼ������շ��������������շ��������������п��Ӧ�����������壬������ͨ��������ƿ�з�����ӦII: 3H2S+KIO3=3S��+KI+ 3H2O��������ػ�ԭ��KI������������Һ��������δ��Ӧ�����⣻
(5)ʵ����ģ�ҵ�Ʊ�KIO3����I2��HCl��KClO3ˮ�л�Ϸ���������ԭ��Ӧ������KH(IO3)2��֮���������Ũ������ȴ�ᾧ�����˵õ�KH(IO3)2���壬����KOH��Һ��Ϸ�����Ӧ�����������ᾧ�õ�����ؾ��塣
(1)���շ������з����ķ�Ӧ����п��ϡ���ᷴӦ�����������������п����Ӧ�Ļ�ѧ����ʽ��ZnS+H2SO4===H2S��+ZnSO4�����������ṹ��֪������Ϊ��ѹ��Һ©����
(2)�ⵥ��ˮ��Һ���ػ�ɫ�������������غ�ⵥ�ʷ�Ӧ���ɵ���غ͵⻯�أ���ȫ��Ӧ����Һ��Ϊ��ɫ��Ȼ������շ�����������ͨ�����巢����ӦII��
(3)��Ӧ��ɺ���Һ���������⣬�������Ტˮԡ���ȿɽ���������ܽ�ȣ�ʹ���ݳ����Ӷ���ȥ���⣻
(4)���ݷ�ӦII��֪��Ӧ���������������ɣ����ʲ�����ˮ��
(5)�ٸ��ݱ������ݿ�֪�¶Ƚϵ�ʱKH(IO3)2���ܽ�Ⱥ�С�����Դӻ��Һ�з���KH(IO3)2������Ҫ����Ũ������ȴ�ᾧ�����ˣ����Բ���aΪ����Ũ������ȴ�ᾧ��
�ڸ������̿�֪�ù����������������������ж�����Ⱦ������ͬʱ�ù����������˸����ҩƷ��
(6)�õζ�ԭ���ǣ��ȼ��������KI���ữ��KIO3������Ӧ��IO3 +5I+ 6H+===3I2+3H2O��Ȼ������Na2S2O3�ⶨ���ɵĵⵥ�ʵ����Ӷ�ȷ��KIO3���������ݷ�Ӧ����ʽ��֪IO3 ~3I2�����ݵζ����̷�ӦI2+2Na2S2O3===2NaI+Na2S4O6��֪I2~2Na2S2O3������IO3 ~6Na2S2O3������n(KIO3)=0.01260L��2.0mol/L��![]() =0.0042mol��������Ʒ��KIO3����������Ϊ
=0.0042mol��������Ʒ��KIO3����������Ϊ![]() =89.88%��
=89.88%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����(����)
A. ��ϩ���Ȼ���ӳɵIJ�����2�� B. ������![]() �Ķ���ȡ������15��
�Ķ���ȡ������15��
C. ������![]() ������ȡ������3�� D. ����ʽΪCCl2F2������ֻ��һ�ֿռ�ṹ
������ȡ������3�� D. ����ʽΪCCl2F2������ֻ��һ�ֿռ�ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.18gD2O��18gH2O�к��е���������Ϊ10NA
B.2L0.5mol/L��������Һ�к��е�H+��Ϊ2NA
C.100mL18.4mol/L��Ũ����������ͭ��Ӧ������SO2�ķ���Ϊ0.92mol
D.���³�ѹ�£�7.0g��ϩ���ϩ�Ļ�����к�����ԭ�ӵ���Ŀ��NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������a mol/L NaX��b mol/L NaY��������Һ������˵����ȷ����
A.��a=b��c(X-)=c(Y-)+c(HY)����HXΪǿ��
B.��a=b��pH(NaX)>pH(NaY)����c(X-)+c(OH-)>c(Y-)+c(OH-)
C.��a>b��c(X-)=c(Y-)��������HX>HY
D.������Һ�������ϣ���c(Na+)=(a+b)mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KMnO4��һ�ָ�Ч���������������������л���ζ��.Ҳ������ˮ�е���������������̡����衢�ӵȷ�Ӧ��ʵ���ҳ���Na2C2O4����Һ�궨δ֪Ũ�ȵ�KMnO4��Һ��������Ӧ:5C2O42-+2MnO4-+16H++4H2O=2[Mn(H2O)6]2++10CO2��������������Ϣ,�����������:
(1)�������Ų�Kλ��Ԫ�����ڱ���_______��,��̬Mn2+�ĺ�������Ų�ʽ�ɱ�ʾΪ_____��
(2)1 mol [Mn( H2O)6]2+�������еĹ��ۼ���ĿΪ__________��
(3)��̬Cԭ�ӵĺ��������ռ������ܼ��ĵ���������ͼΪ_______.C2O42-��̼ԭ�ӵĹ���ӻ�������___________________.
(4)ͬ����Ԫ������������Ӧ����⻯��ķе�:H2O>H2Se>H2S,ԭ����__________��
(5)��-MnSe�Ľṹ��SeΪ�����������ܶѻ��������ṹ��ͼ��ʾ��
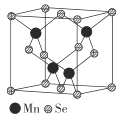
����-MnSe��Mn����λ��Ϊ_____________��
�����þ���ľ�������Ϊapm,�����ӵ�������ֵΪNA������������������ԭ��֮��ľ���Ϊ______pm, ��-MnSe ���ܶ���= ______ ( �г�����ʽ)g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ��(���ķ���)�ķ�����ȷ����( )
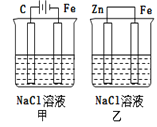
A.��װ������������������������
B.��װ������������������������
C.һ��ʱ���ס���װ����pH������
D.�ס���װ�������缫�ĵ缫��Ӧʽ��Ϊ��2H++2e��H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����«���Ľṹ��ʽΪ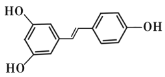 ������Ҫ��ش��������⣺
������Ҫ��ش��������⣺
(1)��«���ķ���ʽΪ______��
(2)��«�����������ŵ�����Ϊ______��
(3)���й��ڰ�«���ķ����ж���ȷ����______������ţ���
A����������״ϩ�� B��������֬��������
C�������ڷ��㻯���� D������������������
(4)�߱����������İ�«����ͬ���칹����______�֣�д������һ��ͬ���칹��Ľṹ��ʽ��______��
��̼�Ǽܺ���������� �����������϶��й�����
(5)�Ҵ���![]() �������ӣ�
�������ӣ�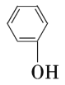 �����«��������
�����«��������![]() ������˵����ȷ����______������ţ���
������˵����ȷ����______������ţ���
A���Ҵ��Ͱ�«������ͬһ�����л���
B���������«����Ϊͬϵ��
C�����ߵ����Ԫ����ͬ
D�����߷�����̼����ԭ�Ӹ�������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ��������Һ100mL���������ۣ�����������������ۼ������ı仯��ͼ��ʾ������˵��������ǣ� ��

A��H2SO4Ũ��Ϊ4mol/L
B����Һ����������ΪFeSO4
C��ԭ�������NO3��Ũ��Ϊ0.2mol/L
D��AB�η�ӦΪ��Fe+2Fe3+��3Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ�ͺ�ú���Եõ��л�������������Ҫ���ڶ�ԭ�ϣ�������ʯ�͵õ�����ϩ����ú�õ��ı����ƾ۱���ϩ�������������£�
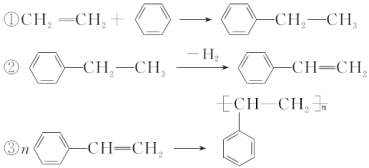
����˵������ȷ����(����)
A. ͨ���ѽ���Դ�ʯ���л�ø������ϩ
B. ͨ��ú�ĸ�����ֱ�ӵõ������ı�
C. �ƾ۱���ϩ�ķ�Ӧ��Ϊ�ӳɷ�Ӧ
D. ��Ӧ�٢ڢ۵�ԭ�������ʶ��ﵽ��100%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com