
����Ŀ���о����������̼��������ȴ�����Ⱦ��Ĵ���������Ҫ���塣
I.��֪����N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ��mol-1
��CO��ȼ���ȡ�H=-283 kJ��mol-1��
(1)�����������ڰ�װ�Ĵ�ת��������ʹβ������Ҫ��Ⱦ��(NO��CO)ת��Ϊ���Ĵ���ѭ�����ʣ��÷�Ӧ���Ȼ�ѧ����ʽΪ________________________________��
(2)һ���¶��£��ں����ܱ������г���1 mol NO��2 mol CO���и÷�Ӧ�����в����жϷ�Ӧ�ﵽ��ѧƽ��״̬����___________(��������)
�ٵ�λʱ��������a mol CO��ͬʱ����2a mol NO
�ڻ�������ƽ����Է����������ٸı�
�ۻ��������NO��CO�����ʵ���֮�ȱ��ֲ���
�ܻ��������ܶȲ��ٸı�
II.��������������������Լ�����������ӦΪ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ��(t)�仯������±���
N2O5(g)+O2(g)����ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⡣��Ӧ������n(O2)��ʱ��(t)�仯������±���
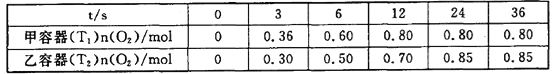
(3)T1______T2(��>��<��=����ͬ)���÷�Ӧ��H________0��
(4)�������У�0��3s�ڵ�ƽ����Ӧ����v(NO2)=________��
(5)��������NO2ƽ��ת����Ϊ__________��T1ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________��
���𰸡�2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5 kJ/mol �٢� > < 0.24 mol/(L��s) 80.0% 20
N2(g)+2CO2(g) ��H=-746.5 kJ/mol �٢� > < 0.24 mol/(L��s) 80.0% 20
��������
I��(1)����֪�������Ȼ�ѧ����ʽ���ӣ��ɵ���Ӧ���Ȼ�ѧ����ʽ��
(2)���ݻ�ѧƽ��״̬��������𣬵���Ӧ�ﵽƽ��״̬ʱ�������淴Ӧ������ȣ������ʵ�Ũ�ȡ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯��
II��(3)������Ӧ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)���¶ȸߣ����ʿ죬�ﵽƽ������Ҫ��ʱ�����̣��ݴ˷����Ƚ��¶ȣ������¶���O2��ƽ�⺬�������жϣ�
N2O5(g)+O2(g)���¶ȸߣ����ʿ죬�ﵽƽ������Ҫ��ʱ�����̣��ݴ˷����Ƚ��¶ȣ������¶���O2��ƽ�⺬�������жϣ�
(4)���ڼ������У�0��3s�ڵ�ƽ����Ӧ����v(NO2)=2v(O2)������ͼ�����ݼ��������ķ�Ӧ���ʵõ���
(5)����O2��ƽ��Ũ�ȼ���������ʵ�ƽ��Ũ�ȣ�Ȼ����������ת���ʵ���ת��������ʼ���ıȼ���NO2��ת���ʣ�����ƽ�ⳣ�������������¶�ΪT1ʱ��ƽ�ⳣ����
I��(1)��֪����N2(g)+O2(g)=2NO(g) ��H=+180.5 kJ/mol
��CO��ȼ���ȡ�H=-283 kJ/mol���Ȼ�ѧ����ʽ��CO(g)+![]() O2(g)=CO2(g) ��H=-283.0 kJ/mol
O2(g)=CO2(g) ��H=-283.0 kJ/mol
���ݸ�˹���ɼ������2-�ٵõ��÷�Ӧ���Ȼ�ѧ����ʽ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=-746.5 kJ/mol��
N2(g)+2CO2(g) ��H=-746.5 kJ/mol��
(2)�ٵ�λʱ��������a mo1CO��ͬʱ����2a mol NO����Ӧ������У������淴Ӧ���ʲ��ȣ�˵��û�з�Ӧ�ﵽƽ��״̬���ٴ���
�ڷ�Ӧǰ�������������䣬�������ʵ���Ϊ����������������ƽ����Է����������ٸı䣬˵������ֵ�Ũ�Ȳ��ٱ仯���÷�Ӧ�ﵽƽ��״̬������ȷ��
��һ���¶��£��ں����ܱ������г���1 mol NO��2 mol CO���и÷�Ӧ����Ӧ��NO��CO����1��1��Ӧ���У����������NO��CO�����ʵ���֮�ȱ��ֲ��䣬˵����Ӧ�ﵽƽ��״̬������ȷ��
�ܷ�Ӧǰ������������������䣬���������ܶ�ʼ�ղ��ı䣬���ܸ��ݻ��������ܶ��ж�ƽ��״̬���ܴ���
�ʺ���ѡ���Ǣ٢ܣ�
II��(3)���淴Ӧ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)���ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⣬ͼ�����ݿ�֪���������дﵽƽ��ʱ��̣����ʿ죬˵����Ӧ���¶ȸߣ�����¶�T1>T2�����ݱ������ݿ�֪�������¶ȣ���Ӧ�ﵽƽ��ʱ O2�ĺ������¶ȵ�ʱ�ͣ�˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����ø÷�Ӧ������ӦΪ���ȷ�Ӧ�����ԡ�H<0��
N2O5(g)+O2(g)���ס������������Ϊ1.0 L�ĺ����ܱ������зֱ����2.0 mol NO2��1.0 mol O3���ֱ���T1��T2�¶��£�����һ��ʱ���ﵽƽ�⣬ͼ�����ݿ�֪���������дﵽƽ��ʱ��̣����ʿ죬˵����Ӧ���¶ȸߣ�����¶�T1>T2�����ݱ������ݿ�֪�������¶ȣ���Ӧ�ﵽƽ��ʱ O2�ĺ������¶ȵ�ʱ�ͣ�˵�������¶ȣ���ѧƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����ø÷�Ӧ������ӦΪ���ȷ�Ӧ�����ԡ�H<0��
(4)�������У�0��3s�ڵ�ƽ����Ӧ����v(NO2)=2v(O2)=2�� =0.24 mol/(L��s)��
=0.24 mol/(L��s)��
���ڼ�������������Ӧ2NO2(g)+O3(g)![]() N2O5(g)+O2(g)����Ӧ�ﵽƽ��ʱn(O2)=0.8 mol����ͬʱ��Ӧn(N2O5)=n(O2)=0.8 mol����Ӧ����n(O3)=0.8 mol��n(NO2)=2��0.8 mol=1.6 mol������ƽ��ʱn(N2O5)=2.0 mol-1.6 mol=0.4 mol��n(O3)=1.0 mol-0.8 mol=0.2 mol��n(N2O5)=n(O2)=0.8 mol�����Լ�������NO2ƽ��ת����=
N2O5(g)+O2(g)����Ӧ�ﵽƽ��ʱn(O2)=0.8 mol����ͬʱ��Ӧn(N2O5)=n(O2)=0.8 mol����Ӧ����n(O3)=0.8 mol��n(NO2)=2��0.8 mol=1.6 mol������ƽ��ʱn(N2O5)=2.0 mol-1.6 mol=0.4 mol��n(O3)=1.0 mol-0.8 mol=0.2 mol��n(N2O5)=n(O2)=0.8 mol�����Լ�������NO2ƽ��ת����=![]() ��100%=80.0%����Ӧ�������ݻ���1L�����Ը������ʵ�ƽ��ʱ�����ʵ���Ϊ���ʵ�ƽ��Ũ�ȣ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
��100%=80.0%����Ӧ�������ݻ���1L�����Ը������ʵ�ƽ��ʱ�����ʵ���Ϊ���ʵ�ƽ��Ũ�ȣ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=![]() =20��
=20��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C(s)+CO2(g)![]() 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ����֪�������ѹ��p����=������ѹ��p�������������������˵����ȷ���ǣ� ��
2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ����֪�������ѹ��p����=������ѹ��p�������������������˵����ȷ���ǣ� ��
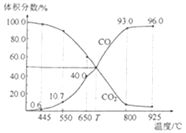
A.550��ʱ��������ϡ�����壬v����v������С��ƽ�ⲻ�ƶ�
B.T��ʱ����Ӧ��ƽ���CO2��ת����Ϊ50%
C.T��ʱ��������������CO2��CO��ƽ�ⲻ�ƶ�
D.925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp=24.0p��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȲΪԭ���ڲ�ͬ�����¿��Ժϳɶ����л��
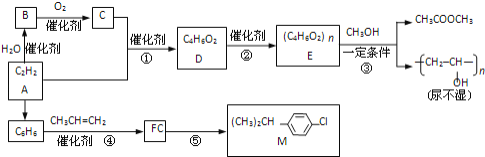
��֪����CH2=CHOH�����ȶ���![]() CH3CHO
CH3CHO
��һ�������£��������ᷢ��������Ӧ��RCOOR��+R��OH![]() RCOOR��+R��OH
RCOOR��+R��OH
���������գ�
��1��д��Ӧ���ͣ���__��Ӧ����__��Ӧ����Ӧ�ݵķ�Ӧ����__��
��2��д����Ӧ����ʽ��B����C__����Ӧ��__��
��3��R��M��ͬϵ��仯ѧʽΪ![]() ����R��__�֣�
����R��__�֣�
��4��д����̼̼˫�����ܷ���������Ӧ����������D��ͬ���칹��Ľṹ��ʽ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ���Ũ�ȵ�NaOH��Na2CO3�Ļ����Һ�м���ϡ���ᣮ�������ӷ���ʽ��������ʵ�������
A.OH��+2CO32��+3H+��2HCO3��+H2O
B.2OH��+CO32��+3H+��HCO3��+2H2O
C.2OH��+CO32��+4H+��CO2��+3H2O
D.OH��+CO32��+3H+��CO2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̿�������ǹ�ҵ ������Ҫ����֮һ�����������£�
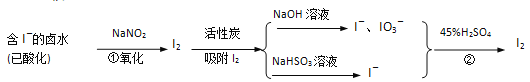
���������գ�
(1)���������£�NaNO2��Һֻ�ܽ�I������ΪI2��ͬʱ����NO��д����Ӧ�ٵ����ӷ���ʽ���������ת�Ƶķ������Ŀ___________________________________________________��
(2)������Ũ���ᡢ���Ը�����صȶ��dz��õ�ǿ������������ҵ������±ˮ�е�I��ѡ���˼۸����˵��������ƣ����ܵ�ԭ����____________________________________��
(3)��Ӧ�ڷ���ʱ����Һ�ײ����Ϻ�ɫ�������ɣ���ʱ��Һ�Ϸ�������ɫ���壬�������������ԭ����_______________________________________��
(4)�����У���Ԫ�ؾ�����I����I2��I����IO3����I2�ı仯���̣���������������Ŀ����___________��
(5)���������õ�NaHSO3��Һ�������ԣ�Դ��NaHSO3�������̶ֳȲ�ͬ��ƽ����ϵ��ˮ��_______________________________�͵���_______________________________�������ӷ���ʽ��ʾ��
(6)����0.1mol/L��NaHSO3��Һ�зֱ�����������ʣ��ش����⣺
�ټ�������Ba(OH)2���壬ˮ��ƽ����_________�ƶ���
�ڼ�������NaClO���壬��Һ��pH_________��ѡ�����С�����䣩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������к͵ζ�ԭ��Ҳ�����������ʵζ������磺������ij��ѧѧϰС���ͬѧ�Բ��ᾧ����е�̽����ѧϰ�Ĺ��̣�������벢Э������������ѧϰ������ͬѧ�о������ǣ�̽���ⶨ���ᾧ��(H2C2O4��xH2O)�е�xֵͨ����������֪�ã�����������ˮ��ˮ��Һ����������KMnO4��Һ���еζ���2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O
ѧϰС���ͬѧ����˵ζ��ķ����ⶨxֵ��
�ٳ�ȡ2.52 g�����ᾧ�壬�������Ƴ�100.00 mLˮ��ҺΪ����Һ��
��ȡ25.00 mL����Һ������ƿ�У��ټ���������ϡH2SO4��
����Ũ��Ϊ0.1000 mol��L-1������KMnO4����Һ���еζ����ﵽ�յ�ʱ����20.00 mL���ʣ�
(1)ͨ���������ݣ�����x=_____________��
(2)�ζ��յ�ʱ���ӵζ��̶ܿȣ����ɴ˲�õ�xֵ��_______(����ƫ��������ƫС������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�2L�ܱ������У������ƺ�CO2���Ƶý��ʯ��4Na+3CO22Na2CO3+C(s�����ʯ)��
��1��������Ӧ���漰��Ԫ��ԭ�ӵİ뾶�Ӵ�С��˳��Ϊ��___��
��2����֤��̼Ԫ������Ԫ�طǽ�����ǿ������ʵ��___(ѡ���ţ���
a�����������ˮ��������� b������Ԫ�ص���̬�⻯��ķе�
c��CO2��Ԫ�صĻ��ϼ� d����������Ӧ�����׳̶�
��3����ѹ�£���ѧ�ҳɹ��ؽ�CO2ת��Ϊ��������SiO2�ṹ��ԭ�Ӿ��壬�Ƚ�����ԭ�Ӿ�����۷е㣺___����˵�����ɣ�___�����˽��ʯ�⣬̼�ĵ��ʻ�������ͬ�������壬����ʯī��C60�ȡ�ʯīϩ����̼ԭ�ӹ��ɵĵ���Ƭ״�ṹ���²��ϣ�����ʯī������ɣ���Ŀǰ���ֵ����ǿ������絼��������ǿ��һ���²��ϡ�
��4��ʯīϩ�е�̼ԭ�Ӽ���___����ϣ����й���ʯīϩ��������ȷ����___��
A.ʯīϩ��ʯī����ͬλ��
B.ʯīϩ��ʯī��ȫȼ�յIJ��ﶼ�Ƕ�����̼
C.ʯīϩ��һ��ϩ����
D.12gʯīϩ�к���6.02��1022��̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(N2H4)�ʹ�������(NaH2PO2)������ǿ��ԭ��.�����Ź㷺����;��
(1)��֪:��N2H4(l)+O2(g)=N2(g)+2H2O(g) ��H=-621.5 kJ��mol-1
��N2O4(l)-=N2(g)+2O2(g) ��H2=+204.3 kJ��mol-1
����ȼ�ϵ�ȼ�շ�ӦΪ2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ��H=_____.
(2)��֪��ӦN2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T��Cʱ,��V L�����ܱ������м���2 mol N2H4(g)��4 mol Cl2(g) ,���Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
N2(g)+4HCl(g),T��Cʱ,��V L�����ܱ������м���2 mol N2H4(g)��4 mol Cl2(g) ,���Cl2��HCl��Ũ����ʱ��Ĺ�ϵ��ͼ��ʾ��
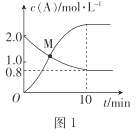
��0~ 10 min��,��N2(g)��ʾ��ƽ����Ӧ����v(N2)=_______��
��M��ʱ,N2H4��ת����Ϊ______(��ȷ��0.1)%��
��T ��Cʱ,�ﵽƽ�������������м���1.2 mol N2H4(g)��0.4 mol Cl2(g)��0. 8 mol N2 (g)��1.2 mol HCl(g) ,��ʱƽ��______(���������ƶ����������ƶ����������ƶ���)��
(3)���ڶ���������,������(P4)��ʯ�����̼������Һһͬ��������黯��Ӧ�����Ƶ�NaH2PO2,ͬʱ����������(PH3)����,�÷�Ӧ�Ļ�ѧ����ʽΪ________________��
�ڴ�����(H3PO2)��һԪ�ᣬ������.1.0 mol��L-1��NaH2PO2��ҺpHΪ8,��������Ka=___________��
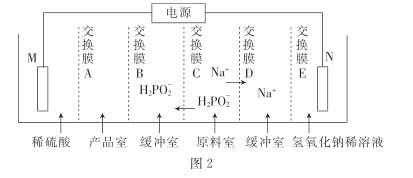
���ô�������ͨ�����������Ʊ�������.װ����ͼ2��ʾ������ĤA����____(������������������������)����Ĥ,�缫N�ĵ缫��ӦʽΪ______,����·������3.8528��105���ص���ʱ.�Ƶô���������ʵ���Ϊ_____ (һ�����ӵĵ���Ϊ 1.6��10- 19����,NA��ֵԼΪ6. 02�� 1023)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ϡHNO3��Cu��ȡ����NO����֤�������������ʵ�װ�ã�����˵��������ǣ�������

A.���ռ�������NaOH��ҺB.�Թ��ϲ�������ʼ��Ϊ��ɫ
C.С�Թ�����Һ���ճ���ɫD.��ֽ�ȱ�����ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com