
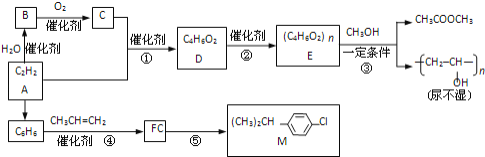
【题目】乙炔为原料在不同条件下可以合成多种有机物.
已知:①CH2=CHOH(不稳定)![]() CH3CHO
CH3CHO
②一定条件下,醇与酯会发生交换反应:RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
完成下列填空:
(1)写反应类型:③__反应;④__反应.反应⑤的反应条件__.
(2)写出反应方程式.B生成C__;反应②__.
(3)R是M的同系物,其化学式为![]() ,则R有__种.
,则R有__种.
(4)写出含碳碳双键、能发生银镜反应且属于酯的D的同分异构体的结构简式__.
【答案】取代反应 加成反应 铁粉作催化剂 2CH3CHO+O2![]() 2CH3COOH nCH3COOCH=CH2
2CH3COOH nCH3COOCH=CH2![]()
 4 HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)C=CH2
4 HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)C=CH2
【解析】
与乙烯水化法得到乙醇类似,乙炔与水反应得到乙烯醇,乙烯醇不稳定会自动变成乙醛,因此B为乙醛,C为乙醛催化氧化后得到的乙酸,乙酸和乙炔在一定条件下加成,得到![]() ,即物质D,而D在催化剂的作用下可以发生加聚反应得到E
,即物质D,而D在催化剂的作用下可以发生加聚反应得到E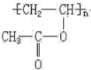 ,E与甲醇发生酯交换反应,这个反应在题干信息中已经给出。再来看下面,
,E与甲醇发生酯交换反应,这个反应在题干信息中已经给出。再来看下面,![]() 为苯,苯和丙烯发生反应得到异丙苯,即物质F,异丙苯和
为苯,苯和丙烯发生反应得到异丙苯,即物质F,异丙苯和![]() 发生取代得到M,注意反应⑤取代的是苯环上的氢,因此要在铁粉的催化下而不是光照下。
发生取代得到M,注意反应⑤取代的是苯环上的氢,因此要在铁粉的催化下而不是光照下。
(1)反应③是酯交换反应,实际上符合取代反应的特征,反应④是一个加成反应,这也可以从反应物和生成物的分子式来看出,而反应⑤是在铁粉的催化下进行的;
(2)B生成C即乙醛的催化氧化,方程式为2CH3CHO+O2![]() 2CH3COOH,而反应②为加聚反应,方程式为nCH3COOCH=CH2
2CH3COOH,而反应②为加聚反应,方程式为nCH3COOCH=CH2![]()
 ;
;
(3)说白了就是在问我们丁基有几种,丁基一共有4种,因此R也有4种;
(4)能发生银镜反应说明有醛基,但是![]() 中只有2个氧原子,除酯基外不可能再有额外的醛基,因此只能是甲酸酯,符合条件的结构有HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)C=CH2。
中只有2个氧原子,除酯基外不可能再有额外的醛基,因此只能是甲酸酯,符合条件的结构有HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)C=CH2。


科目:高中化学 来源: 题型:
【题目】a、b、c、d为原子序数依次增大的短周期不同主族元素,其中只有一种为金属元素,四种元素的单质在通常情况下只有一种不是气体,b与d的最外层电子数之和为a与c最外层电子数之和的四倍。下列叙述不正确的是
A. 原子半径:c>d>a
B. d的氧化物对应的水化物酸性均比b的强
C. a、b、d三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了解有机物A的性质,对A的结构进行了如下实验。
实验一:通过质谱分析仪分析得知有机物A的相对分子质量为90。
实验二:用红外光谱分析发现有机物A中含有-COOH和-OH。
实验三:取1.8g有机物A完全燃烧后,测得生成物为2.64gCO2和1.08gH2O。
实验四:经核磁共振检测发现有机物A的谱图中H原子峰值比为3:1:1:1。
(1)有机物A的结构简式为__。
(2)有机物A在一定条件下可以发生的反应有__。
a.消去反应 b.取代反应 c.聚合反应 d.加成反应 e.氧化反应
(3)有机物A在浓硫酸作用下可生成多种产物。其中一种产物B的分子式为C3H4O2,B能和溴发生加成反应,则B的结构简式为__。另一种产物C是一种六元环状酯,写出生成C的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知短周期元素![]() 、
、![]() ,
,![]() 元素原子的最外层电子数为
元素原子的最外层电子数为![]() ,次外层电子数为
,次外层电子数为![]() ;
;![]() 元素原子的
元素原子的![]() 层(有电子)电子数为
层(有电子)电子数为![]() ,
,![]() 层电子数为
层电子数为![]() ,则
,则![]() 为______(填元素符号,下同),
为______(填元素符号,下同),![]() 为______.
为______.
(2)已知![]() 元素原子的
元素原子的![]() 层比
层比![]() 元素原子的
元素原子的![]() 层少3个电子,
层少3个电子,![]() 元素原子的核外电子总数比
元素原子的核外电子总数比![]() 元素原子的多5,则
元素原子的多5,则![]() 、
、![]() 分别为______、______。
分别为______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 丙烯与氯化氢加成的产物有2种 B. 联二苯![]() 的二氯取代物有15种
的二氯取代物有15种
C. 立方烷![]() 的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
的六氯取代物有3种 D. 分子式为CCl2F2的物质只有一种空间结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)基态碳原子的核外电子排布式为______。非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是______(填序号)。
A.甲的金属性比乙强
B.乙有![]() 价
价
C.丙不可能为非金属元素
D.丁一定为金属元素
(3)![]() 、
、![]() 均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 |
|
| |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态![]() 的价电子排布式:______,比较两元素的I2、I3可知,气态
的价电子排布式:______,比较两元素的I2、I3可知,气态![]() 再失去1个电子比气态
再失去1个电子比气态![]() 再失去1个电子难,对此你的解释是______。
再失去1个电子难,对此你的解释是______。
(4)卤族元素![]() 、
、![]() 、
、![]() 、
、![]() 的电负性由小到大的顺序是______。
的电负性由小到大的顺序是______。
(5)基态![]() 原子的电子排布式为______;
原子的电子排布式为______;![]() 和
和![]() 相比,电负性较大的是______;
相比,电负性较大的是______;![]() 中
中![]() 元素的化合价为______。
元素的化合价为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,对于0.10molL﹣1的氨水,下列判断正确的是
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH﹣═Al(OH)3↓
B.用HNO3溶液完全中和后,溶液不显中性
C.加水稀释后,溶液中c(NH4+)c(OH﹣)变大
D.1L0.1molL﹣1的氨水中有6.02×1022个NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I.已知:①N2(g)+O2(g)=2NO(g) △H=+180.5 kJ·mol-1
②CO的燃烧热△H=-283 kJ·mol-1。
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为________________________________。
(2)一定温度下,在恒容密闭容器中充入1 mol NO和2 mol CO进行该反应,下列不能判断反应达到化学平衡状态的是___________(用序号填空)
①单位时间内消耗a mol CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II.臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
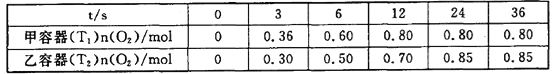
(3)T1______T2(填>、<或=,下同),该反应△H________0。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=________。
(5)甲容器中NO2平衡转化率为__________,T1时该反应的平衡常数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图装置(铁的防护)的分析正确的是( )
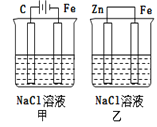
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com