
����Ŀ��a��b��c��dΪԭ��������������Ķ����ڲ�ͬ����Ԫ��������ֻ��һ��Ϊ����Ԫ��������Ԫ�صĵ�����ͨ�������ֻ��һ�ֲ���������b��d������������֮��Ϊa��c����������֮�͵��ı���������������ȷ����
A. ԭ�Ӱ뾶��c>d>a
B. d���������Ӧ��ˮ�������Ծ���b��ǿ
C. a��b��d����Ԫ���γɵĻ�������ܼȺ����Ӽ��ֺ����ۼ�
D. ���ʵ��۵���c>b>a
���𰸡�B
��������������b��d������������֮��Ϊa��c����������֮�͵��ı���a��b��c��dΪԭ��������������Ķ����ڲ�ͬ����Ԫ�أ�a��b��c��d������������ͬ��a��c����������֮������Ϊ3��b��d������������֮������Ϊ12����a��b��c��d��ֻ��һ��Ϊ����Ԫ�أ�����Ԫ�صĵ�����ͨ�������ֻ��һ�ֲ������壬����������Ԫ�صĵ���ͨ������³���̬����H��N��O��F��Cl�����������aΪHԪ�أ�bΪNԪ�أ�cΪMgԪ����dΪClԪ����
�����b��d������������֮��Ϊa��c����������֮�͵��ı���a��b��c��dΪԭ��������������Ķ����ڲ�ͬ����Ԫ�أ�a��b��c��d������������ͬ��a��c����������֮������Ϊ3��b��d������������֮������Ϊ12����a��b��c��d��ֻ��һ��Ϊ����Ԫ�أ�����Ԫ�صĵ�����ͨ�������ֻ��һ�ֲ������壬����������Ԫ�صĵ���ͨ������³���̬����H��N��O��F��Cl�����������aΪHԪ�أ�bΪNԪ�أ�cΪMgԪ����dΪClԪ����A���������ྶ�����С����ԭ�Ӱ뾶��c![]() d
d![]() a��A����ȷ��B�d���������Ӧ��ˮ������HClO��HClO2��HClO3��HClO4��b���������Ӧ��ˮ������HNO3��HNO2��d���������Ӧˮ��������Բ�һ����b��ǿ�������ԣ�HClO
a��A����ȷ��B�d���������Ӧ��ˮ������HClO��HClO2��HClO3��HClO4��b���������Ӧ��ˮ������HNO3��HNO2��d���������Ӧˮ��������Բ�һ����b��ǿ�������ԣ�HClO![]() HNO3��B�����C�a��b��d����Ԫ���γɵĻ�������NH2Cl��NH4Cl����NH2Cl��ֻ�����ۼ���NH4Cl�мȺ����Ӽ��ֺ����ۼ���C����ȷ��D�H2��N2���³���̬��H2����Է�������С��N2����Է���������H2���Ӽ�������С��N2���Ӽ���������Mg���³ʹ�̬�����ʵ��۵㣺c
HNO3��B�����C�a��b��d����Ԫ���γɵĻ�������NH2Cl��NH4Cl����NH2Cl��ֻ�����ۼ���NH4Cl�мȺ����Ӽ��ֺ����ۼ���C����ȷ��D�H2��N2���³���̬��H2����Է�������С��N2����Է���������H2���Ӽ�������С��N2���Ӽ���������Mg���³ʹ�̬�����ʵ��۵㣺c![]() b
b![]() a��D����ȷ����ѡB��
a��D����ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͼ�Ǧ���ؾ��ּӹ��ɵõ�Ǧ��,����Ҫ�ɷ�ΪPbO��PbO2��PbSO4�ȡ���Ǧ��Ϊԭ�ϻ���PbSO4,��������:
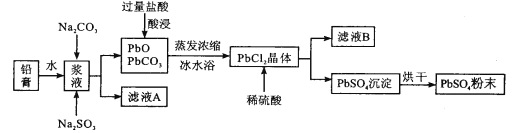
��֪:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)��H>0
PbCl42-(aq)��H>0
(1)��Na2CO3��ת��������Ǧ���е�����Ǧת��Ϊ̼��Ǧ,�����ӷ���ʽΪ_______��
(2)��Һ�м���Na2SO3��Һ��Ŀ����________��
(3)����ҺA��ȡNa2SO4��10H2O���壬��Ҫ����Ϊ______��______�����ˡ�ϴ�ӡ�������������п�ѭ�����õ�������_________(д��ѧʽ)��
(4)���ñ�ˮԡ��PbCl2�����ԭ����________��
(5)������Ҫ�õ�a�ֵ�PbSO4,��Ǧ���������ΧΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵������ȷ����
A. CaCO3(s)=CaO(s)��CO2(g)�����²����Է����У�˵���÷�Ӧ�ġ�H��0 ����S��0
B. N2(g)��3H2(g)![]() 2NH3(g) ��H��0��������������ʱ�����¶ȣ���Ӧ����v(H2)��������ƽ��ת���ʾ�����
2NH3(g) ��H��0��������������ʱ�����¶ȣ���Ӧ����v(H2)��������ƽ��ת���ʾ�����
C. ˮ�ⷴӦNH4����H2O![]() NH3��H2O��H���ﵽƽ��������¶�ƽ��������Ӧ�����ƶ�
NH3��H2O��H���ﵽƽ��������¶�ƽ��������Ӧ�����ƶ�
D. ˮ�����ӻ�����Kw�����¶ȵ����߶�����˵��ˮ�ĵ����Ƿ��ȹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƫ�����ƣ�Na6P6O18��������ʳƷ�ӹ�����ƫ����������Ԫ�صĻ��ϼ�Ϊ��������
A.��3
B.+2
C.+4
D.+5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijǿ������ҺX�н�����Ba2����Al3����NH4����Fe2����Fe3����CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ���������
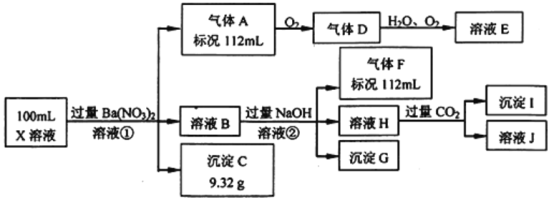
����������Ϣ���ش���������:
(1)��������������ʵ�鲻��ȷ����ҺX���Ƿ��е����ӷֱ���________��
(2)������������������Ũ��Ϊ2 mol/L��������10 mLʱ��ʼ����������55 mLʱ���������ﵽ���ֵ0.03 mol�������μӳ����������ֲ��䣬����ٵμӳ��������ܽ⣬��60 mLʱ����������Ϊ0.025 mol�ұ��ֲ��䣬��ԭ��Һ����c(Fe2+)Ϊ_____mol/L��c(Fe3+)Ϊ______mol/L��c(Cl-)Ϊ_____mol/L��(����Щ���Ӳ����ڣ�����0 mol/L)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijdz��ɫ����X[x(NH4)2SO4��yFeSO4��zH2O]�ڷ�����ѧ�г�������ԭ��. Ϊȷ������ɣ�ijС��ͬѧ��������ʵ�飮
I��NH4+�IJⶨ
������������װ����ͼ��ʾ��
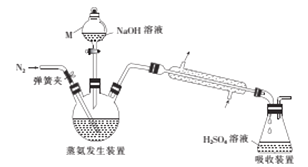
��ص�ʵ�鲽�����£�
��ȷ��ȡ58.80g����X����ˮ�ܽ����Һע��������ƿ�У�
��ȷ��ȡ50.00mL3.0300molL-1H2SO4��Һ����ƿ�У�
����������ƿ�м�������NaOH��Һ��ͨ�뵪��������������������ȡ����ƿ��
����0.120molL-1NaOH����Һ�ζ���ƿ�й��������ᣬ�ζ��յ�ʱ����25.00mL NaOH����Һ��
��1������M������Ϊ__________��
��2��������У�������������ԭ��Ӧ�Ļ�ѧ����ʽΪ____________������������Ϊ�˼���ʵ�����,����Ҫ��ֱ�������ܽ����������������������IJ���������_____________��
��3��������У�����ʱ��ƿ����Һ�彦����������õ�n(NH4+)��ֵ��______(����ƫ������ƫС������������)��
II.SO42-�����IJⶨ
����������������ʵ�鲽������:
����ȷ��ȡ58.80g����X ���ձ��У���ˮ�ܽ⣬�߽�����������BaCl2��Һ��
�ڽ��õ�����Һ������ֽ(�ҷ�������С,�ɺ���)���ˣ�ϴ�ӳ���3~4�Σ�
������ֽ�����ó���ȡ����������ֽ������ֽ��ȫ�һ���
�ܼ������ճ��������ء��������ó�������Ϊ69.90g��
��4���������,�ж�BeCl ��Һ�ѹ�����ʵ�������������___________��
��5���������,������ˮϴ����,����ҪĿ����___________��
��6�����ʵ����ͨ������ó�����X�Ļ�ѧʽΪ__________��ʵ��I �IJ������,��Һ�������ܶ��ɴ�С��˳��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��һ����Ҫ�ķ�Ӧ���ڹ�ũҵ�������ճ������ж��й㷺����;��
��1����ҩ���й��ġ��Ĵ�����֮һ����Զֵ�������セ�����ڻ�ҩ�ڷ�����ըʱ���������·�Ӧ��2KNO3��3C��S��K2S��N2����3CO2�������б�������Ԫ����____________����ԭ������____________��
��2��ʵ����Ϊ�������й������ĺ�������������Ϳ��CuI����ֽ��������ֽ�Ƿ��ɫ����ɫ�����仯����ȥ��ʱ�����жϿ����еĺ��������䷴ӦΪ4CuI��Hg��Cu2HgI4��2Cu��
��������Ӧ����Cu2HgI4�У�CuԪ����________�ۡ�
�����Ϸ�Ӧ�е�������Ϊ________������1 mol CuI���뷴Ӧʱ��ת�Ƶ���________mol��
�۱���������Ӧ����ת�Ƶķ������Ŀ______________________________��
��3����ҵ�ϳ������Ը��������Һ��������CuS��Cu2S�Ŀ���䷴Ӧԭ�����£�
8MnO4����5Cu2S��44H����10Cu2����5SO2����8Mn2����22H2O
6MnO4����5CuS��28H����5Cu2����5SO2����6Mn2����14H2O
����������Ӧԭ����ijѧϰС����400 mL 0.075 mol��L��1�����Ը��������Һ����2 g����CuS��Cu2S�Ļ�����Ӧ�������Һ���Ͼ�SO2��ʣ���KMnO4ǡ����350 mL 0.1 mol��L��1��(NH4)2Fe(SO4)2��Һ��ȫ��Ӧ��
����ƽKMnO4��(NH4)2Fe(SO4)2��Ӧ�����ӷ���ʽ��
______MnO4����______Fe2����______H����______Mn2����______Fe3����______H2O��
��KMnO4��Һ��������ﷴӦ��ʣ��KMnO4�����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾͼ����,������Ϊ����������ʵ���,������Ϊij��Һ�м��뷴Ӧ������ʵ���,��ʾ��MgCl2��AlCl3�Ļ����Һ�еμ�NaOH��Һ��������ͼ����( )
A.  B.
B. 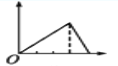 C.
C. 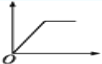 D.
D. 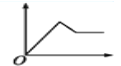
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1molL-1NaHCO3��Һ��pH=8.31���йظ���Һ���ж���ȷ����
A. c(Na+)��c(OH-)��c(HCO3-)��c(CO32-)��c(H+)
B. Ka1(H2CO3)Ka2(H2CO3)��KW
C. c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-)
D. ��������NaOH��Һ��c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com