
����Ŀ��������ԭ��Ӧ��һ����Ҫ�ķ�Ӧ���ڹ�ũҵ�������ճ������ж��й㷺����;��
��1����ҩ���й��ġ��Ĵ�����֮һ����Զֵ�������セ�����ڻ�ҩ�ڷ�����ըʱ���������·�Ӧ��2KNO3��3C��S��K2S��N2����3CO2�������б�������Ԫ����____________����ԭ������____________��
��2��ʵ����Ϊ�������й������ĺ�������������Ϳ��CuI����ֽ��������ֽ�Ƿ��ɫ����ɫ�����仯����ȥ��ʱ�����жϿ����еĺ��������䷴ӦΪ4CuI��Hg��Cu2HgI4��2Cu��
��������Ӧ����Cu2HgI4�У�CuԪ����________�ۡ�
�����Ϸ�Ӧ�е�������Ϊ________������1 mol CuI���뷴Ӧʱ��ת�Ƶ���________mol��
�۱���������Ӧ����ת�Ƶķ������Ŀ______________________________��
��3����ҵ�ϳ������Ը��������Һ��������CuS��Cu2S�Ŀ���䷴Ӧԭ�����£�
8MnO4����5Cu2S��44H����10Cu2����5SO2����8Mn2����22H2O
6MnO4����5CuS��28H����5Cu2����5SO2����6Mn2����14H2O
����������Ӧԭ����ijѧϰС����400 mL 0.075 mol��L��1�����Ը��������Һ����2 g����CuS��Cu2S�Ļ�����Ӧ�������Һ���Ͼ�SO2��ʣ���KMnO4ǡ����350 mL 0.1 mol��L��1��(NH4)2Fe(SO4)2��Һ��ȫ��Ӧ��
����ƽKMnO4��(NH4)2Fe(SO4)2��Ӧ�����ӷ���ʽ��
______MnO4����______Fe2����______H����______Mn2����______Fe3����______H2O��
��KMnO4��Һ��������ﷴӦ��ʣ��KMnO4�����ʵ���Ϊ________mol��
���𰸡�C K2S��N2 ��1 CuI 0.5 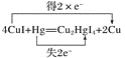 1��5��8��1��5��4 0.007
1��5��8��1��5��4 0.007
��������
��1�����ϼ����ߵ�Ԫ�ر�����������������ԭ�õ���ԭ���
��2���ٸ��ݻ������������۴�����Ϊ0���
������Ԫ�ػ��ϼ۽��͵�������������������Cu��HgԪ�صĻ��ϼ۱仯����ת�Ƶ��ӵ����ʵ�����
�۸���Cu��HgԪ�صĻ��ϼ۱仯��������ת�������
��3���ٸ���Mn��FeԪ�صĻ��ϼ۱仯��ϵ��ӵ�ʧ�غ���
�ڸ��ݷ���ʽ���㡣
��1����Ӧ2KNO3��3C��S��K2S��N2����3CO2����̼Ԫ�ػ��ϼ����ߣ���˱�������Ԫ����C����Ԫ�غ���Ԫ�ػ��ϼ۽��ͣ�����ԭ�����Ի�ԭ������K2S��N2��
��2����Cu2HgI4��Hg��+2�ۣ�I�ǣ�1�ۣ����������۴�����Ϊ0��֪CuԪ����+1�ۡ�
�ڸ��ݷ���ʽ��֪CuI��ͭԪ�ػ��ϼ۴�+1�۽��͵�0�ۣ��õ�1�����ӣ����Է�Ӧ�е�������ΪCuI�����ݷ���ʽ��֪4molCuI�μӷ�Ӧת��2mol���ӣ�����1 mol CuI���뷴Ӧʱ��ת�Ƶ���0.5mol��
�۷�Ӧ��HgԪ�ػ��ϼ۴�0�����ߵ�+2�ۣ�ʧȥ2�����ӣ���������Ӧ����ת�Ƶķ������Ŀ�ɱ�ʾΪ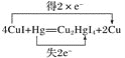 ��
��
��3���ٷ�Ӧ��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�ۣ��õ�5�����ӣ�FeԪ�ػ��ϼ۴�+2�����ߵ�3�ۣ�ʧȥ1�����ӣ����ݵ��ӵ�ʧ�غ㡢ԭ���غ�͵���غ��֪��Ӧ�ķ���ʽΪMnO4����5Fe2����8H����Mn2����5Fe3����4H2O��
�ڷ�Ӧ�������������ӵ����ʵ�����0.35L��0.1mol/L��0.035mol�����ݷ�Ӧ����ʽMnO4����5Fe2����8H����Mn2����5Fe3����4H2O��֪ʣ����������0.035mol��5��0.007mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ���ǣ� ��
A. ![]() 2���һ����� B.
2���һ����� B. ![]() 2����Ȳ
2����Ȳ
C. ![]() ����ױ� D.
����ױ� D. ![]() 2������2����ϩ
2������2����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������Һ��ͨ����Ӧ����������ҺpH=7��ͨ���������Һ�����Ӱ��ɺ��ԣ�����Һ�в����������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A. ��0.10mol��L��1NH4HCO3��Һ��ͨ��CO2��c(NH4��)=c(HCO3��)��c(CO32��)
B. ��0.10mol��L��1NaHSO3��Һ��ͨ��NH3��c(Na��)>c(NH4��)>c(SO32��)
C. 0.10mol��L��1Na2SO3��Һͨ��SO2��c(Na��)=2[c(SO32��)��c(HSO3��)��c(H2SO3)]
D. 0.10mol��L��1CH3COONa��Һ��ͨ��HCl��c(Na��)>c(CH3COOH)=c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��dΪԭ��������������Ķ����ڲ�ͬ����Ԫ��������ֻ��һ��Ϊ����Ԫ��������Ԫ�صĵ�����ͨ�������ֻ��һ�ֲ���������b��d������������֮��Ϊa��c����������֮�͵��ı���������������ȷ����
A. ԭ�Ӱ뾶��c>d>a
B. d���������Ӧ��ˮ�������Ծ���b��ǿ
C. a��b��d����Ԫ���γɵĻ�������ܼȺ����Ӽ��ֺ����ۼ�
D. ���ʵ��۵���c>b>a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2Mg��O2![]() 2MgO�Ļ�ѧ��Ӧ�У�
2MgO�Ļ�ѧ��Ӧ�У�
��1����Ԫ�صĻ��ϼ���0�۽���Ϊ________�ۣ�������________�ۣ������õ����ӵ�����Ϊ________��
��2��þԭ��ʧȥ���ӵ�����Ϊ________��1 mol Mg��Ӧʱת�Ƶ��ӵ����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH3��CH===CH2��HBr�D��CH3��CHBr��CH3(��Ҫ����)��1 molij��A���ȼ�պ���Եõ�8 mol CO2��4 mol H2O������A�ڲ�ͬ�������ܷ�������ͼ��ʾ��һϵ�б仯��
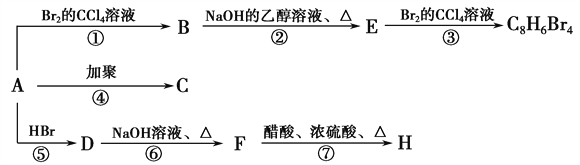
��1��A�Ļ�ѧʽ��___________________��
��2��A�Ľṹ��ʽ��_________________________��
��3��д��C��D��E��H���ʵĽṹ��ʽ��
C____________________��D________________��E________________��H_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ˮ�����ӻ�����KWֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
B. Ksp���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
C. �����£�CH3COOH��Ka=1.7��10-5��NH3��H2O��Kb=1.7��10-5��CH3COOH��ҺҺ�е�c(H+)��NH3��H2O��Һ��c(OH-)���
D. �����¡���0.1moL��NH3��H2O��Һ�м�������NH4Cl���壬��ʹ��Һ��pH��С��c(NH4+)/(NH3��H2O)��ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2SO3![]() HSO3-+H+ Kal��HSO3-
HSO3-+H+ Kal��HSO3-![]() SO32-+H+ Ka2��25��ʱ����ijŨ�ȵ�H2SO3��Һ����εμ�һ��Ũ�ȵ�NaOH��Һ��������Һ��H2SO3��HSO3-��SO32-�����������ʵ�������(��)����ҺpH�Ĺ�ϵ��ͼ��ʾ������˵���������
SO32-+H+ Ka2��25��ʱ����ijŨ�ȵ�H2SO3��Һ����εμ�һ��Ũ�ȵ�NaOH��Һ��������Һ��H2SO3��HSO3-��SO32-�����������ʵ�������(��)����ҺpH�Ĺ�ϵ��ͼ��ʾ������˵���������
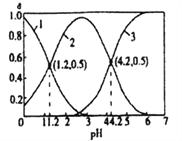
A. ����3��ʾ������SO32-
B. 25��ʱ��Kal/ Ka2=1000
C. ��Һ��pH=1.2ʱ����Һ����c(Na+)+c(H+)=c(OH-)+c(H2SO3)
D. �ܶɵ�Ph=4.2ʱ����Һ����c(Na+)+c(H+)=c(OH-)+2c(SO32-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Fe 2 (SO 4 ) 3 ��Al 2 (SO 4 ) 3 �Ļ����Һ�У���μ���NaOH��Һ������������ͼ���У�����ȷ��ʾ������Ӧ����
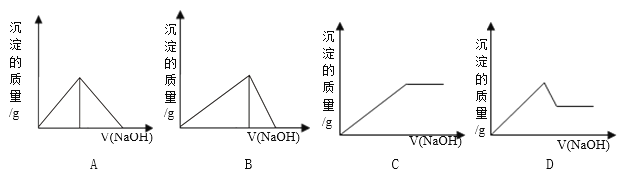
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com