
【题目】在2Mg+O2![]() 2MgO的化学反应中:
2MgO的化学反应中:
(1)氧元素的化合价由0价降低为________价,降低了________价;氧气得到电子的总数为________。
(2)镁原子失去电子的总数为________,1 mol Mg反应时转移电子的物质的量为________。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
(1)“溶解浸取”时,下列措施不能提高铜的浸取率的是__________(填序号)。
a.将海绵铜粉末与水搅拌成浆液 b.投料时,NaNO3适当过量
c.缩短浸取时间 d.将滤渣1返回再次溶解浸取
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图-1、图-2所示:
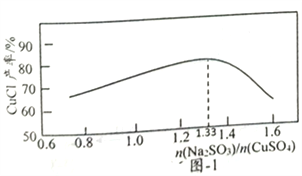

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离了方程式为__________。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是__________。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是__________。
(3)“过滤2”所得滤液中溶质的主要成分为__________(填化学式)。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。为了高效利用这两种矿石,科研人员开发了综合利用这两种资源的同槽酸浸工艺,主要流程如下图所示,回答下列问题:
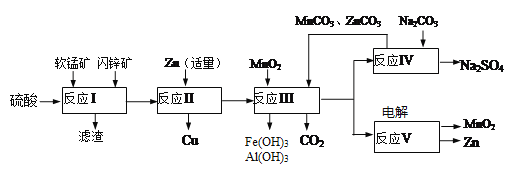
(1)反应Ⅰ所得滤液中含有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阴离子,所得滤液中含有S和______。为了提高硫酸“酸浸”时的浸出速率,可进行的操作是(至少两条):_________。
(2)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式方为_________。
(3)反应Ⅲ中加入MnO2的作用是(离子方程式表示)________;反应Ⅲ中加入MnCO3、ZnCO3的作用是________________。
(4)反应Ⅴ的电解总反应为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
(5)MnO2和Zn可按等物质的量之比生产锌-锰干电池,则从生产MnO2和Zn的角度计算,所用软锰矿和闪铲矿的质量比大约是______。(保留小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下
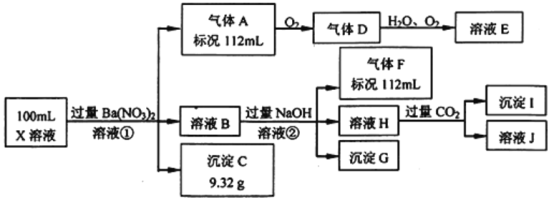
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的离子分别是________。
(2)若②中所用氢氧化钠浓度为2 mol/L,当加入10 mL时开始产生沉淀,55 mL时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60 mL时沉淀的量降为0.025 mol且保持不变,则原溶液中:c(Fe2+)为_____mol/L、c(Fe3+)为______mol/L、c(Cl-)为_____mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,向x g KNO3不饱和溶液中加入a g KNO3或蒸发掉b g水,恢复到t ℃,溶液均达到饱和,据此,下列推论不正确的是( )
A. 在t ℃时,KNO3的溶解度为![]() g
g
B. 若原溶液中溶质的质量分数为![]() ,则x=2b
,则x=2b
C. 在t ℃时,所配的KNO3溶液中溶质的质量分数为w≤![]() %
%
D. 若将原溶液蒸发掉2b g水,恢复到原温度析出2a g KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目______________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______MnO4-+______Fe2++______H+=______Mn2++______Fe3++______H2O。
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为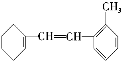
据此填写下列空格。
(1)该物质苯环上一氯代物有________种;
(2)1 mol该物质和溴水混合,消耗Br2的物质的量为________mol;
(3)1 mol该物质和H2加成需H2________mol;
(4)下列说法不正确的是________。
A.该物质可发生加成、取代、氧化等反应
B.该物质与甲苯属于同系物
C.该物质使溴水褪色的原理与乙烯相同
D.该物质使酸性KMnO4溶液褪色发生的是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-![]()
B. 检验试液中的Fe2+![]()
C. 检验试液中的I-![]()
D. 检验试液中的CO32-![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-11。某溶液中含有Cl-,Br-,CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-、
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com