
����Ŀ��ijǿ������ҺX�н�����Ba2����Al3����NH4����Fe2����Fe3����CO32����SO32����SO42����Cl����NO3���е�һ�ֻ��֣�ȡ����Һ��������ʵ�飬ʵ���������
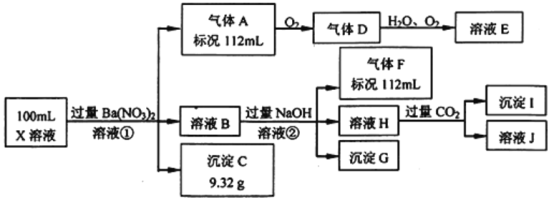
����������Ϣ���ش���������:
(1)��������������ʵ�鲻��ȷ����ҺX���Ƿ��е����ӷֱ���________��
(2)������������������Ũ��Ϊ2 mol/L��������10 mLʱ��ʼ����������55 mLʱ���������ﵽ���ֵ0.03 mol�������μӳ����������ֲ��䣬����ٵμӳ��������ܽ⣬��60 mLʱ����������Ϊ0.025 mol�ұ��ֲ��䣬��ԭ��Һ����c(Fe2+)Ϊ_____mol/L��c(Fe3+)Ϊ______mol/L��c(Cl-)Ϊ_____mol/L��(����Щ���Ӳ����ڣ�����0 mol/L)
���𰸡�Fe3+��Cl- 0.15 0.1 0.4
��������
(1)ǿ������Һ��һ���������CO32����SO32��������������ᱵ���ɳ�������ó���ΪBaSO4��˵����Һ�к���SO42������������A��A��������������D��E����AΪNO��DΪNO2��EΪHNO3��˵����Һ�к��л�ԭ�����ӣ�һ��ΪFe2+���������������º�NO3����Ӧ����NO����ҺB�м������NaOH��Һ������GΪFe(OH)3����������F����FΪNH3��˵����Һ�к���NH4+����ҺH��ͨ��CO2���壬���ɳ���I����IΪAl(OH)3��HΪNaOH��NaAlO2��˵����Һ�к���Al3+����Һ�к���Fe2+����һ������NO3��������SO42����һ������Ba2+������ȷ���Ƿ��е�Fe3+��Cl����
(2)���ݵ�ʧ��������Ⱥ��������ӵ�������������ͬ�����
(1)�ɷ�����֪����ȷ���Ƿ��е���Fe3+��Cl����
(2) n(NO)=![]() =0.005 mol�����ݵ�ʧ��������֪n(Fe2+)= n(NO)��3=0.015 mol��c(Fe2+)=0.015mol��0.1L=0.15mol/L����������������Һ60mLʱ����������0.025mol��˵����ʱΪ���������������������ӵ����ʵ�����0.015mol������˵��ԭ��Һ�д��������ӣ�n(Fe3+)=0.025mol��0.015mol=0.01mol����c(Fe3+)=0.01mol/0.1L=0.1mol/L������55mL����������Һʱ�����ﵽ���ֵ0.03mol������60mL����������Һʱ��������Ϊ0.025mol��˵��n(Al(OH)3)=0.03mol��0.025mol=0.005mol������Һ��SO42����0.04mol��NH4+��0.005mol��Fe2+��0.015mol��Fe3+��0.01mol��Al3+��0.005mol����ʱ2n(SO42��)=n(NH4+)+2n(Fe2+)+3n(Fe3+)+3n(Al3+)������c(Cl��)=0.4 mol/L��
=0.005 mol�����ݵ�ʧ��������֪n(Fe2+)= n(NO)��3=0.015 mol��c(Fe2+)=0.015mol��0.1L=0.15mol/L����������������Һ60mLʱ����������0.025mol��˵����ʱΪ���������������������ӵ����ʵ�����0.015mol������˵��ԭ��Һ�д��������ӣ�n(Fe3+)=0.025mol��0.015mol=0.01mol����c(Fe3+)=0.01mol/0.1L=0.1mol/L������55mL����������Һʱ�����ﵽ���ֵ0.03mol������60mL����������Һʱ��������Ϊ0.025mol��˵��n(Al(OH)3)=0.03mol��0.025mol=0.005mol������Һ��SO42����0.04mol��NH4+��0.005mol��Fe2+��0.015mol��Fe3+��0.01mol��Al3+��0.005mol����ʱ2n(SO42��)=n(NH4+)+2n(Fe2+)+3n(Fe3+)+3n(Al3+)������c(Cl��)=0.4 mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶���,ˮ��Һ��c(H+)��c(OH-)����ͼ��ʾ��ϵ������˵����ȷ����

A. b����Һ�в����ܴ���NH3��H2O
B. b��c����pH��ͬ,����Һ������Բ�ͬ
C. ͨ�����µķ�������ʹ��Һ��״̬��d���Ϊa��
D. a����Һ�п��ܴ�����������ӣ�Fe3+��Na+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������Һ��ͨ����Ӧ����������ҺpH=7��ͨ���������Һ�����Ӱ��ɺ��ԣ�����Һ�в����������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A. ��0.10mol��L��1NH4HCO3��Һ��ͨ��CO2��c(NH4��)=c(HCO3��)��c(CO32��)
B. ��0.10mol��L��1NaHSO3��Һ��ͨ��NH3��c(Na��)>c(NH4��)>c(SO32��)
C. 0.10mol��L��1Na2SO3��Һͨ��SO2��c(Na��)=2[c(SO32��)��c(HSO3��)��c(H2SO3)]
D. 0.10mol��L��1CH3COONa��Һ��ͨ��HCl��c(Na��)>c(CH3COOH)=c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. �ױ�������H2�ӳɲ����һ��ȡ������5��
B. ![]() ��3�ֵ���Ӿ۵õ�
��3�ֵ���Ӿ۵õ�
C. ˫�ǡ�������ϡ��Ĵ������վ�ˮ��Ϊ������
D. ����ʽΪC4H6O2�����뱥��NaHCO3��Һ��Ӧ����CO2���л�����3��(���������칹)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c��dΪԭ��������������Ķ����ڲ�ͬ����Ԫ��������ֻ��һ��Ϊ����Ԫ��������Ԫ�صĵ�����ͨ�������ֻ��һ�ֲ���������b��d������������֮��Ϊa��c����������֮�͵��ı���������������ȷ����
A. ԭ�Ӱ뾶��c>d>a
B. d���������Ӧ��ˮ�������Ծ���b��ǿ
C. a��b��d����Ԫ���γɵĻ�������ܼȺ����Ӽ��ֺ����ۼ�
D. ���ʵ��۵���c>b>a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2Mg��O2![]() 2MgO�Ļ�ѧ��Ӧ�У�
2MgO�Ļ�ѧ��Ӧ�У�
��1����Ԫ�صĻ��ϼ���0�۽���Ϊ________�ۣ�������________�ۣ������õ����ӵ�����Ϊ________��
��2��þԭ��ʧȥ���ӵ�����Ϊ________��1 mol Mg��Ӧʱת�Ƶ��ӵ����ʵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ˮ�����ӻ�����KWֻ���¶��йأ�������ᡢ���һ����Ӱ��ˮ�ĵ���̶�
B. Ksp���������ܵ���ʵ����ʺ��¶��йأ�������Һ��������ӵ�Ũ���й�
C. �����£�CH3COOH��Ka=1.7��10-5��NH3��H2O��Kb=1.7��10-5��CH3COOH��ҺҺ�е�c(H+)��NH3��H2O��Һ��c(OH-)���
D. �����¡���0.1moL��NH3��H2O��Һ�м�������NH4Cl���壬��ʹ��Һ��pH��С��c(NH4+)/(NH3��H2O)��ֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ�仯�������������
A. ��ѧ�仯һ�����������仯
B. ��ѧ�仯һ���л�ѧ���Ķ��Ѻ�����
C. ��ѧ�仯һ���������ʵ�״̬�仯
D. ��ѧ�仯һ��������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com