
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法正确的是

A. b点溶液中不可能存在NH3·H2O
B. b、c两点pH相同,但溶液的酸碱性不同
C. 通过降温的方法,可使溶液的状态中d点变为a点
D. a点溶液中可能大量共存的离子:Fe3+、Na+、Cl-、SO42-
科目:高中化学 来源: 题型:
【题目】已知NaHCO3的溶解度较小。在饱和的NH3和NaCl的混合溶液中通入CO2,可析出NaHCO3(固体):NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。据此,我国杰出的化学家侯德榜设计出了生产纯碱的方法:
饱和NaCl(溶液)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
这种方法被人们称为侯氏制碱法,打破了帝国主义对我国经济的一种封锁,大长了中国人的民族志气。
试回答下列问题:
(1)写出由NaHCO3固体制取Na2CO3的化学方程式:__________________。
(2)如果Na2CO3(固体)中混有NaHCO3(固体),应如何除去?_____________(写出方法);如果NaHCO3(溶液)中混有Na2CO3(溶液),应如何除去?________(写出化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
(1)“溶解浸取”时,下列措施不能提高铜的浸取率的是__________(填序号)。
a.将海绵铜粉末与水搅拌成浆液 b.投料时,NaNO3适当过量
c.缩短浸取时间 d.将滤渣1返回再次溶解浸取
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图-1、图-2所示:
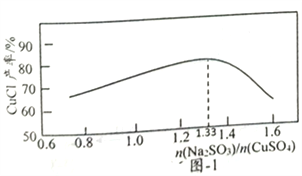

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离了方程式为__________。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是__________。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是__________。
(3)“过滤2”所得滤液中溶质的主要成分为__________(填化学式)。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.二氧化硅分子由1个硅原子和2个氧原子构成
B.二氧化硅和晶体硅都是良好的半导体材料
C.玛瑙和红宝石的主要成分都是二氧化硅
D.二氧化硅属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习化学可以防止走入生活和学习的误区.你认为下列说法不正确的是( )
A.水银不是银,而是金属汞
B.纯碱不是碱,而是盐
C.干冰不是冰,而是固体二氧化碳
D.烧碱不是碱,而是一种常见的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 、△S>0
B. N2(g)+3H2(g)![]() 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
C. 水解反应NH4++H2O![]() NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
D. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿主要含有MnO2(约70%)、SiO2、Al2O3,闪锌矿主要含有ZnS(约80%)、FeS、CuS、SiO2。为了高效利用这两种矿石,科研人员开发了综合利用这两种资源的同槽酸浸工艺,主要流程如下图所示,回答下列问题:
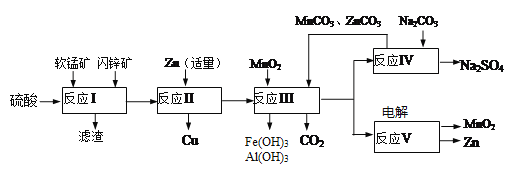
(1)反应Ⅰ所得滤液中含有Mn2+、Zn2+、Cu2+、Fe3+、Al3+等金属阴离子,所得滤液中含有S和______。为了提高硫酸“酸浸”时的浸出速率,可进行的操作是(至少两条):_________。
(2)若反成Ⅱ加入的锌过量,还会进一步发生反应的离子方程式方为_________。
(3)反应Ⅲ中加入MnO2的作用是(离子方程式表示)________;反应Ⅲ中加入MnCO3、ZnCO3的作用是________________。
(4)反应Ⅴ的电解总反应为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
MnO2+Zn+2H2SO4,写出阳极的电极反应式________________。
(5)MnO2和Zn可按等物质的量之比生产锌-锰干电池,则从生产MnO2和Zn的角度计算,所用软锰矿和闪铲矿的质量比大约是______。(保留小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下
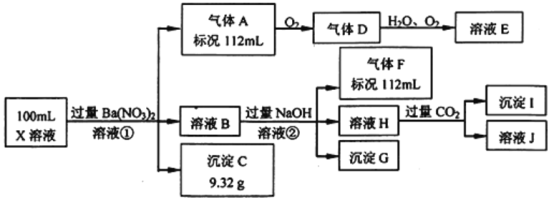
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的离子分别是________。
(2)若②中所用氢氧化钠浓度为2 mol/L,当加入10 mL时开始产生沉淀,55 mL时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60 mL时沉淀的量降为0.025 mol且保持不变,则原溶液中:c(Fe2+)为_____mol/L、c(Fe3+)为______mol/L、c(Cl-)为_____mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-![]()
B. 检验试液中的Fe2+![]()
C. 检验试液中的I-![]()
D. 检验试液中的CO32-![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com